题目内容
【题目】(7分)金属铁、铝、铜在生产和生活中有广泛的应用。
(1)地壳中含量最多的金属元素是 。
(2)金属铜做导线是利用其延展性和 性。
(3)铁是应用最广泛的金属。工业常用赤铁矿(主要成分Fe2O3)和一氧化碳在高温条件下炼铁,该反应的化学方程式为_ 。
(4)实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置。
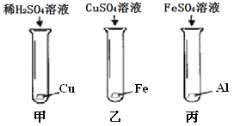
①乙实验的现象为_______________________________________________
②若将上述实验之一替换掉一种药品,即可达成实验目的。说明具体的改进方法:________________________________________________
③按如图实验结束后,将乙、丙实验后的剩余物倾倒至一个烧杯中,充分反应。然后将甲实验的剩余物倒入此烧杯,无气泡产生。以下说法正确的是________(填序号) 。
A. 最后烧杯中的溶液不可能是无色的
B. 乙实验中,CuSO4溶液一定是过量的
C. 乙、丙混合过程中,可能没有发生化学反应
D. 最后烧杯中的溶液,一定含有Al2(SO4)3,可能含有FeSO4
【答案】(1)铝(或Al) (2)导电 (3)3CO+Fe2O3 高温 2Fe+3CO2
(4)① 铁表面附着红色固体,溶液由蓝色变为浅绿色
② 将乙实验中的硫酸铜溶换为稀硫酸 ③ A B
【解析】
试题分析:(1)地壳中含量前三位:氧、硅、铝,含量最多的金属元素是铝(或Al)
(2)性质决定用途,金属铜做导线是利用其延展性和导电性
(3)赤铁矿(主要成分Fe2O3)和一氧化碳在高温条件下炼铁,该反应的化学方程式为:3CO+Fe2O3 高温 2Fe+3CO2
(4)①因为铁的活动性比铜强,所以铁能将铜置换出来,发生的反应:Fe+CuSO4==Cu+FeSO4,乙实验的现象为:铁表面附着红色固体,溶液由蓝色变为浅绿色
②实验甲证明Cu>H,实验乙证明Fe>Cu,实验丙证明Al>Fe,就是不知道铁与氢的活动性,所以具体的改进方法:将乙实验中的硫酸铜溶换为稀硫酸
③将乙、丙实验后的剩余物倾倒至一个烧杯中,充分反应。然后将甲实验的剩余物倒入此烧杯,无气泡产生,说明将乙、丙实验后的剩余物没有活泼金属铁和铝,所以溶液中一定有FeSO4,浅绿色溶液,所以A、最后烧杯中的溶液不可能是无色的,正确,B、因为丙实验一定有活泼金属铁或铝存在,但将乙、丙实验后的剩余物混合后,就没有活泼金属铁或铝,说明乙实验中CuSO4溶液一定是过量的,把铁或铝反应完全了,正确,C、 乙、丙混合过程中,如果可能没有发生化学反应,那么就一定存在铁,这样将甲实验的剩余物倒入此烧杯,就会有气泡产生,错误,D. 最后烧杯中的溶液,一定含有FeSO4、Al2(SO4)3,可能含有CuSO4

 阅读快车系列答案
阅读快车系列答案