题目内容
某化学兴趣小组为了探究金属的化学性质,进行如下两个实验。
实验一:将铝丝伸入硫酸铜溶液中,反应的方程式为 。
实验二:向铁粉中加入过量的稀硫酸,观察到的现象是 ,充分反应后溶液中的阳离子有 。
通过以上两个实验总结出金属的化学性质有 。利用金属的化学性质可知,把Zn转化成ZnSO4的方法是将Zn和 溶液反应。
2Al +3CuSO4 = Al2(SO4)3 +3Cu 有气泡产生,溶液由无色变成浅绿色(固体逐渐溶解) Fe2+、H+金属能与盐反应,金属能与酸反应(合理即可) H2SO4(CuSO4)(合理即可)
解析试题分析:铝与硫酸铜发生置换反应,生成硫酸铝和铜;铁与硫酸反应,生成氢气,会产生大量的气泡,生成的硫酸亚铁溶液呈浅绿色;铁与过量的硫酸反应,故反应后的阳离子有生成的硫酸亚铁中的亚铁离子和剩余硫酸中的氢离子;实验一说明金属能与盐反应,实验二说明金属能与酸反应;锌可与稀硫酸或硫酸铜溶液反应生成硫酸锌。
考点:金属的化学性质

人类的生产、生活离不开金属。
(1)目前年产量最高的金属是 ;
(2)铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是 ;
| A.①② | B.①③ | C.②③ | D.①②③ |
(4)氧化铝难溶于水,能溶于酸或强碱溶液,它溶于氢氧化钠溶液,反应生成偏铝酸钠(NaAlO2)和水。请结合以上信息写出氧化铝与氢氧化钠溶液反应的化学方程式: 。
(5)在硫酸铜、硫酸锌和稀硫酸的混合溶液中,加入过量的铁粉(铁粉有剩余),使之充分反应后,过滤,则滤渣的成分是 ,滤液中含有的微粒是 。
在实验课中,各小组作了如下实验:
| 实验编号 | 1 | 2 | 3 | 4 |
| 实验操作 | 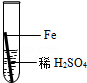 | 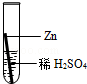 | 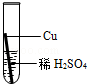 | 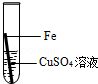 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
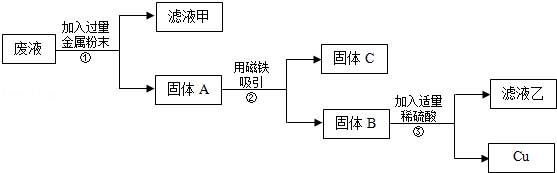
则固体C是 ,操作③的名称是 ,实验中所加的过量金属粉末是 .
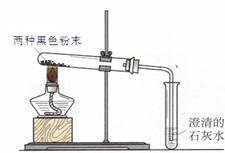
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是__________________________________;
(2)实验一:
| 实验操作 | | |
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变_________ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
(4)实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变_______,澄清石灰水变____________。写出两种黑色粉末发生反应的化学方程式__________________。

 Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
 2Fe+3C02,该反应中体现了C0具有 性;
2Fe+3C02,该反应中体现了C0具有 性;