题目内容
【题目】t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
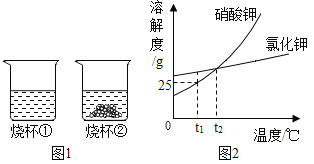
(1)烧杯②中的上层清液是否达到饱和状态?____(填“是”、“否”或“无法判断”);
(2)烧杯②中溶解的溶质是____(填化学式);
(3)t1℃时200g硝酸钾的饱和溶液中含有硝酸钾的质量为____g;
(4)关于图1 中烧杯内的物质,下列说法正确的是____。
A 烧杯①内溶液中溶质的质量分数<烧杯②内上层清液中溶质的质量分数
B 蒸发一定量的水,烧杯②一定有固体析出
C 将两个烧杯中的溶液混合,充分搅拌后,烧杯中可能还有氯化钾没有溶解
D 将温度升高到t2℃,烧杯②中固体一定全部溶解(不考虑水的蒸发)
E 将温度升高到t2℃,烧杯①内溶液的质量 = 烧杯②内溶液的质量(不考虑水的蒸发)
【答案】是 KNO3 40 BDE
【解析】
有图可知烧杯②是饱和溶液烧杯①可能是饱和也可能是不饱和溶液,t1℃时①全部溶解
②部分溶解,故t1℃时①中溶质溶解度大于②中溶质溶解度。
(1)有固体未溶解是饱和溶液,故填:是;
(2)t1℃时①全部溶解②部分溶解,故t1℃时①中溶质溶解度大于②中溶质溶解度,为KCl②中溶质为KNO3,故填:KNO3
(3)t1℃时200g硝酸钾的饱和溶液中含有硝酸钾的质量为;
![]() 故填:40
故填:40
(4)A、等质量的固体溶解在水中,烧杯①中没有固体剩余,烧杯②中有固体剩余,所以烧杯①内溶液中溶质的质量分数大于烧杯②内上层清液中溶质的质量分数,故A 错;
B、烧杯②为饱和溶液,蒸发一定量的水,烧杯②一定有固体析出,故B正确;
C、烧杯①内为氯化钾已经全部溶解,将两个烧杯中的溶液混合,充分搅拌后,烧杯中不可能还有氯化钾没有溶解,故C错误;
D、设t1℃时氯化钾的溶解度为S1, t2℃时氯化钾硝酸钾溶解度相等为S2,由图像可知S1< S2,设硝酸钾和氯化钾的质量为mg,因为t1℃时①全部溶解②部分溶解故
![]()
硝酸钾和氯化钾的质量mg小于t2℃时氯化钾硝酸钾溶解度S2,故烧杯②中固体一定全部溶解,过D正确;
E、t2℃时氯化钾硝酸钾全部溶解,溶剂质量相等,溶质质量相等,溶液质量一定也相等,故E正确;
故选:BDE

【题目】某活动小组根据下图所示进行模拟炼铁的实验,并对产物的成分进行探究。
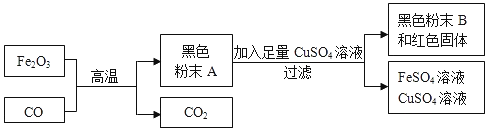
(提出问题)黑色粉末A可能是什么呢?
(进行猜想)(1)小明认为黑色粉末A全部是铁粉。请写出铁粉与CuSO4溶液反应的化学方程式_________________________________。实验过程中采取了过滤,该操作中用到玻璃棒,其中作用是_____________。
(2)小华认为小明的猜想是错误的,理由是__________________。
(3)小华提出了猜想①和猜想②,请结合所学知识补充余下的一个猜想。
猜想①;黑色粉末A由铁粉和四氧化三铁(Fe3O4)组成
猜想②;黑色粉末A由铁粉和氧化亚铁(FeO)组成;
猜想③;_____________________________。
(查阅资料)铁的氧化物都能与稀盐酸,稀硫酸反应,其中氧化铁为红棕色,其余都为黑色,并且只有四氧化三铁能被磁铁吸引。
(实验探究)
方案 | 实验操作 | 可能的现象 | 结论 |
① | 取适量黑色粉末A 用磁铁吸引 | 黑色粉末全部被吸引 | 猜想①正确 |
② | 取适量黑色粉末A 用磁铁吸引 | 黑色粉末部分被吸引 | 猜想②正确 |
③ | 取适量黑色粉末B加入足量稀盐酸 | 黑色粉末全部溶解 | 猜想②正确 |
④ | ________________ | __________________ | 猜想③正确 |
(反思评价)小娟认为方案②和方案③中得出的结论都不正确,其理由是__________________ 。
(得出结论)在高温下,一氧化碳和氧化铁反应可生成铁,氧化亚铁,四氧化三铁。请写出只生成氧化亚铁的方程式_________________________。
【题目】小明同学为了测定市面销售的某品牌纯碱中碳酸钠的质量分数(杂质为氯化钠,氯化钠溶于水且不与氯化钙反应),进行了如下实验:①在三个烧杯中分别加入11.0g 样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%的氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量/g | 55.5 | 120.0 | 150.0 |
白色固体的质量/g | 5.0 | 10.0 | 10.0 |
(1)在图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。______
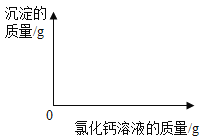
(2)样品中碳酸钠的质量分数是_____?(结果精确到0.1%)
(3)烧杯Ⅱ所得溶液中氯化钠的溶质质量分数是_______?(结果精确到0.1%)
【题目】五氧化二钒(V2O5)广泛用于化工行业。工业上的钒废催化剂主要含硫酸氧钒(VOSO4)和少量的 K2SO4、SiO2 杂质,现要除去杂质并得到 V2O5 固体,其流程如下:
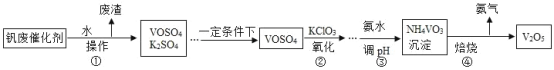
(1)操作①的名称____________________________,废渣的主要成分是____________________________。
(2)农业上,K2SO4 可用作____________________________。
(3)25℃时,取样进行试验分析,得到 NH4VO3,沉淀率和溶液 pH 之间的关系如表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
NH4VO3沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在以上流程中,步骤③中加入氨水调节溶液的最佳 pH 范围为____________________________。
(4)该工艺流程中可以循环利用的物质是____________________________。
(5)步骤④的另一产物是水,该步骤反应的化学方程式为_______________。
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
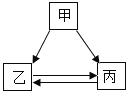
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D