题目内容
在硫酸铜和硫酸亚铁的混合液中加入镁粉,下列说法错误的是( )A.镁粉无剩余,溶液中若有Cu2+,则必有Fe2+
B.镁粉无剩余,溶液中只有Fe2+,而无Cu2+和Mg2+
C.镁粉无剩余,溶液中无Cu2+,则溶液中一定有Mg2+,可能有Fe2+
D.镁粉有剩余,溶液中只有Mg2+,而无Fe2+和Cu2+
【答案】分析:根据金属活动性顺序,镁>铁>铜,镁能与铁和铜的盐溶液反应,置换出里面的金属铁能置换出铜盐中的铜.根据加入的镁粉和原混合液中亚铁盐和铜盐的多少不同,反应后的剩余物质可能会出现多种组成情况,但剩余的物质间不能再发生反应.
解答:解:A、反应完成后镁无剩余,则溶液中若有Cu2+,则一定有Fe2+,因为镁在溶液中先置换活动性弱的金属,如果活动性弱的金属离子没有被置换出来,那么活动性强的金属离子一定没有置换出来了,故A正确;
B、若反应完成后镁无剩余,则溶液中一定有Mg2+,故B错误;
C、镁粉无剩余,溶液中无Cu2+,则溶液中一定有Mg2+,可能有Fe2+,故C正确;
D、镁粉有剩余,就将溶液中的Fe2+和Cu2+全部置换出来,则溶液中只有Mg2+,而无Fe2+和Cu2+,故D正确.
故选B.
点评:本题考查了金属活动性顺序表中镁、铁、铜的活动性强弱,及其金属活动性顺序表的应用,要求学生会利用金属活动性顺序表的应用,来判断反应后的生成物是哪种物质.
解答:解:A、反应完成后镁无剩余,则溶液中若有Cu2+,则一定有Fe2+,因为镁在溶液中先置换活动性弱的金属,如果活动性弱的金属离子没有被置换出来,那么活动性强的金属离子一定没有置换出来了,故A正确;
B、若反应完成后镁无剩余,则溶液中一定有Mg2+,故B错误;
C、镁粉无剩余,溶液中无Cu2+,则溶液中一定有Mg2+,可能有Fe2+,故C正确;
D、镁粉有剩余,就将溶液中的Fe2+和Cu2+全部置换出来,则溶液中只有Mg2+,而无Fe2+和Cu2+,故D正确.
故选B.
点评:本题考查了金属活动性顺序表中镁、铁、铜的活动性强弱,及其金属活动性顺序表的应用,要求学生会利用金属活动性顺序表的应用,来判断反应后的生成物是哪种物质.

练习册系列答案
相关题目
某化学活动小组探究金属的反应规律。
【探究一】在室温条件下进行右图所示实验。
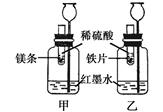
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
【探究一】在室温条件下进行右图所示实验。

已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |
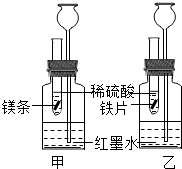 (2012?朝阳区一模)某化学活动小组探究金属的反应规律.
(2012?朝阳区一模)某化学活动小组探究金属的反应规律.