题目内容
【题目】(6分)某化学实验小组用一块表面镀锌的铁样品进行实验探究活动。
【实验探究】将表面镀锌的铁进行如图A实验,加入稀盐酸与产生氢气的质量关系如图B。
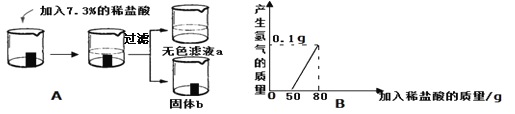
【提出问题】反应后所得的无色滤液a的溶质与固体b的成分是什么?
【猜想假设】秦思认为无色滤液a的溶质是(1) 、氯化亚铁和氯化氢。
【反思评价】请你评价秦思的猜想(2) 。
【推理判断】由无色滤液a 的成分可推知,固体b中一定含有(3) 。
【实验与结论】为验证固体b的成分,单杰向b的样品中加入一种有色物质(4) (填化学式)溶液,产生的现象是(5) ,据此现象,证明出固体b中的两种成分,同时得出这两种金属的活动性顺序。
【表达交流】石建向固体b中继续滴加少量稀盐酸也确定出固体b的成分,他观察到的现象是
(6) 。
【拓展延伸】通过比较锌、铁的活动性,结合图像B在开始加入稀盐酸的过程中并没有产生氢气的现象,你认为在铁的表面镀锌的原因是(7) ,可阻止进一步氧化。
【答案】(1)氯化锌或ZnCl2
(2)不正确 滤液a无色,溶质中不可能含有氯化亚铁,铁未参加反应,铁与盐酸能反应,所以盐酸不能剩余,溶质中也不可能有氯化氢,(据B图像可知)实验中产生了氢气,是锌和稀盐酸反应生成的可溶性的氯化锌(或2HCl+Zn= ZnCl2+ H2↑) ,所以溶质中有氯化锌而没有氯化亚铁和氯化氢
(3)铁(或Fe)
(4)FeCl2[或FeSO4或Fe(NO3)2]
(5)溶液由浅绿色变为无色[或(浅绿色)溶液颜色变浅]
(6)(银白色)固体逐渐减少,固体表面产生气泡,放热,[无色溶液不变色(或无色溶液开始时没变为浅绿色)]
(7)常温下,锌在空气中表面生成一层薄而致密的保护膜
【解析】
试题分析:(1)在表面镀锌的铁中加入稀盐酸,发生反应:Zn + 2HCl === ZnCl2 + H2↑,Fe + 2HCl === FeCl2 + H2↑,秦思认为无色滤液a的溶质是:氯化锌或ZnCl2、氯化亚铁和氯化氢
(2)评价秦思的猜想:不正确,原因是:滤液a无色,溶质中不可能含有氯化亚铁,铁未参加反应,铁与盐酸能反应,所以盐酸不能剩余,溶质中也不可能有氯化氢,(据B图像可知)实验中产生了氢气,是锌和稀盐酸反应生成的可溶性的氯化锌(或2HCl+Zn= ZnCl2+ H2↑) ,所以溶质中有氯化锌而没有氯化亚铁和氯化氢
(3)因为滤液a 是无色的,说明单质铁没有和盐酸反应,故固体b中一定含有铁(或Fe)
(4)要验证固体b的成分,实际上就是验证是不是含有锌,故可向b的样品中加入一种有色物质FeCl2[或FeSO4或Fe(NO3)2]
(5)若产生的现象是:溶液由浅绿色变为无色[或(浅绿色)溶液颜色变浅],说明固体中还含有锌,即证明出固体b中的两种成分,同时得出这两种金属的活动性顺序
(6)根据金属的活动性:锌的活动性大于铁,故锌显与盐酸反应,铁后与盐酸反应,故向固体b中继续滴加少量稀盐酸也确定出固体b的成分,观察到的现象是:(银白色)固体逐渐减少,固体表面产生气泡,放热,[无色溶液不变色(或无色溶液开始时没变为浅绿色)]
(7)通过比较锌、铁的活动性,结合图像B在开始加入稀盐酸的过程中并没有产生氢气的现象,在铁的表面镀锌的原因是:常温下,锌在空气中表面生成一层薄而致密的保护膜,防止铁生锈

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案