题目内容
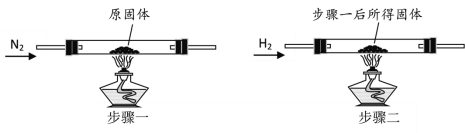
【题目】根据下列实验装置,回答有关问题
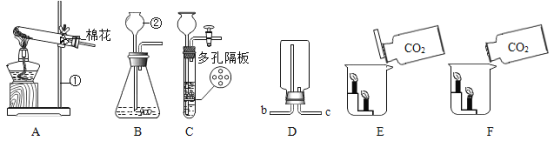
(1)图中标号①的仪器名称为_____;②的仪器名称为_____。
(2)用装置A制取氧气,则A中发生的化学反应方程式为_____;若利用D装置排空气收集氧气时,气体应从_____端进入(选填“b”或“c”);
(3)实验室制取二氧化碳气体的化学反应方程式为_____;装置C相对于装置B的优点_____。
(4)要证明CO2不支持燃烧,密度比空气大的性质,你认为用_____(选填“E”或“F”)装置,操作方法效果更好。
【答案】铁架台 长颈漏斗 ![]() c CaCO3+2HCl=CaCl2+H2O+CO2↑ 能够控制反应的发生与停止 E
c CaCO3+2HCl=CaCl2+H2O+CO2↑ 能够控制反应的发生与停止 E
【解析】
(1)根据实验室常用仪器的名称和用途进行分析解答;
(2)装置A中有酒精灯和棉花,适用高锰酸钾制取氧气,氧气的密度比空气大,用向上排空气法收集;
(3)根据实验室制取二氧化碳的反应原理、装置的特点进行分析解答;
(4)根据实验时的注意事项进行分析解答。
(1)①的仪器名称为铁架台;②的仪器名称为长颈漏斗;
(2)装置A中有酒精灯和棉花,适用高锰酸钾制取氧气,化学方程式为:![]() ;氧气的密度比空气大,要用向上排空气法收集,若利用D装置排空气收集氧气时,气体应从c端进入;
;氧气的密度比空气大,要用向上排空气法收集,若利用D装置排空气收集氧气时,气体应从c端进入;
(3)实验室常用大理石(或石灰石)和稀盐酸反应制取,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,装置C相对于装置B的优点能够控制反应的发生与停止;
(4)要验证CO2不支持燃烧、密度比空气大的性质,用E装置实验操作方法效果更好,因为这样会使二氧化碳先沿烧杯壁进入烧杯的底部。
故答案为:
(1)铁架台 长颈漏斗;(2)![]() c;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑ 能够控制反应的发生与停止;(4)E。
c;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑ 能够控制反应的发生与停止;(4)E。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)m的值为_____g。
(2)12g石灰石样品中碳酸钙的质量_____?
(3)所用稀盐酸溶液中溶质的质量分数_____?
(4)反应完全后最终溶液中氯化钙的质量分数_____?(结果保留小数点后一位小数)