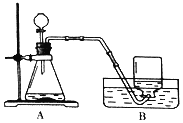
题目内容
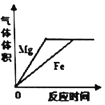
【题目】石灰石的主要成分是CaCO3,某同学为了测定石灰石样品中碳酸钙的质量分数进行了如下实验:取一定量的石灰石样品研碎,然后将其与100g溶质质量分数为10%的稀盐酸一同放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了六次称量,记录数据如下表:(假设反应匀速进行,杂质不溶于水,也不与稀盐酸反应
烧杯的质量为25g)请计算:
反应时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
烧杯和药品质量/g | 140 | 137.8 | 135.6 | m | 134.5 | 134.5 |
(1)表中m的值____;
(2)反应生成二氧化碳的质量____;
(3)该石灰石样品中碳酸钙的质量分数____(计算结果精确至0.1%)。
【答案】134.5g 5.5g 83.3%
【解析】
(1)题目假设反应是匀速进行,由表格数据可知0~20s减少140g-137.8g=2.2g,20s~40s也减少137.8g-135.6g=2.2g,推测到60s 时,如果稀盐酸恰好完全反应,烧杯及剩余物也应该减少2.2g,则m=135.6g-2.2g=133.4g,但是和80s、100s时的数据134.5对比,说明在60s反应已经结束,且盐酸有剩余,则40s~60s不能满足每20s减少2.2g,所以m应为134.5g,故填134.5g;
(2)根据质量守恒定律可得,生成的二氧化碳的质量为140g﹣134.5g=5.5g,故填5.5g;
(3)由题意可知石灰石样品的质量=140g﹣100g﹣25g=15g,根据生成二氧化碳质量和化学方程式进行计算即可,解:设该石灰石样品中碳酸钙的质量分数为x,
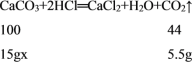
![]() 解得x≈83.3%,写出答即可,故填83.3%。
解得x≈83.3%,写出答即可,故填83.3%。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】填写实验报
实验内容 | 现象 | 理解或解释 |
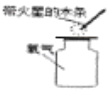
(1)稍移开一瓶氧气的盖玻片,将带火星的木条伸入瓶口,观察现象。
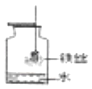
(2)在螺旋状的细铁丝末端系上火柴杆,点燃后烧至快尽时伸入充满氧气且瓶底有少量水的集气瓶中,观察现象。
| 观察到: 带火星木条复燃 观察到: ________ | 实验中带火星的木条发生的现象说明了什么?________性 用化学方程式表示左述实验反应的原理: ________ |