题目内容
【题目】同学们从山上采集到一种石灰石,他们取40克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m/g | 40 | 37.5 | 35 | 33 | 31 | 29 | 29 |
请回答下列问题:
(1)当石灰石完全反应后,生成C02的质量为______g。
(2)求该石灰石中CaC03的质量分数,写出计算过程______。
【答案】11 62.5%
【解析】
本题从碳酸钙分解和化学方程式的有关计算方面分析。
(1)因为固体的质量由40g变为29g,减少了11g,说明生成的气体的质量为11g,故答案为:11;
(2)因为生成的气体的质量为11g,因此可以根据生成的气体的质量即可求出参与反应的碳酸钙的质量,因此,本题正确答案是:
解:设样品中含CaCO3的质量为x。
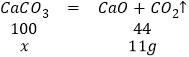
![]()
x=25g
样品中碳酸钙的质量分数为:![]()
答:样品中CaCO3的质量分数为62.5% 。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | m | 0.5g | 0.3g | 0.3g |
计算:
(1)m=______g。
(2)石灰石中碳酸钙的质量分数为______。
(3)2.0g石灰石样品与足量稀盐酸反应,产生二氧化碳的质量是多少?_____(写出解题过程)