题目内容
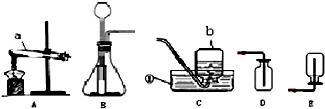
如图1是实验制取气体的常用装置.

(1)如图1中不能直接加热的仪器是 (写名称).写出用a装置制取氧气的化学方程式 .
(2)B装置能起到“随开随制,随关随停”的效果,关闭玻璃旋塞,反应就停止的原因是什么 ?
(3)在实验室里,可以在加热条件下用浓盐酸与二氧化锰反应来制取氯气(Cl2),则制取氯气应选择的发生装置是 (填标号),利用D装置来收集氯气,气体应从 (填“a、b”)端通入氯气有剧毒,且能溶于水,能与氢氧化钠反应,则如何进一步完善D装置?
(4)用如图2实验装置制取干燥的气体正确的是
(5)取49g 10%的稀硫酸,向其中逐滴加入某氢氧化钠溶液,反应过程中,溶液pH的变化如图3所示.计算氢氧化钠溶液中溶质质量分数.

(1)如图1中不能直接加热的仪器是
(2)B装置能起到“随开随制,随关随停”的效果,关闭玻璃旋塞,反应就停止的原因是什么
(3)在实验室里,可以在加热条件下用浓盐酸与二氧化锰反应来制取氯气(Cl2),则制取氯气应选择的发生装置是
(4)用如图2实验装置制取干燥的气体正确的是
| A | B | C | D | |
| X | 大理石 与盐酸 | 锌粒 与稀硫酸 | 双氧水 与二氧化锰 | 二氧化锰 与氯酸钾 |
| Y | 碱石灰 | 浓硫酸 | 浓硫酸 | 浓硫酸 |
| Z | CO2 | H2 | O2 | O2 |
考点:常用气体的发生装置和收集装置与选取方法,气体的干燥(除水),实验室制取氧气的反应原理,有关溶质质量分数的简单计算,根据化学反应方程式的计算
专题:溶质质量分数与化学方程式相结合的计算,常见气体的实验室制法、检验、干燥与净化
分析:制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,但是二氧化碳气体不能用碱石灰干燥.B装置能起到“随开随制,随关随停”的效果,关闭玻璃旋塞,反应就停止的原因是:产生的气体不能导出,压强增大,把液体药品压回长颈漏斗,固液分离,反应停止;在实验室里,可以在加热条件下用浓盐酸与二氧化锰反应来制取氯气(Cl2),则制取氯气应选择的发生装置是C;氯气有剧毒,且能溶于水,因此D中装满饱和氯化钠溶液来收集氯气,因为氯气的密度比氯化钠溶液的密度小,因此应该从短管进入;根据化学方程式的计算要准确.
解答:解:(1)烧瓶是常用的反应容器,如果用高锰酸钾制氧气就需要加热,高锰酸钾在加热的条件下生成锰酸钾和二氧化锰和氧气,配平即可;故答案为:烧瓶;2KMnO4
K2MnO4+MnO2+O2↑;
(2)B装置能起到“随开随制,随关随停”的效果,关闭玻璃旋塞,反应就停止的原因是:产生的气体不能导出,压强增大,把液体药品压回长颈漏斗,固液分离,反应停止;故答案为:产生的气体不能导出,压强增大,把液体药品压回长颈漏斗,固液分离,反应停止;
(3)在实验室里,可以在加热条件下用浓盐酸与二氧化锰反应来制取氯气(Cl2),则制取氯气应选择的发生装置是C;氯气有剧毒,且能溶于水,因此D中装满饱和氯化钠溶液来收集氯气,因为氯气的密度比氯化钠溶液的密度小,因此应该从短管进入;故答案为:C;b;氯气有剧毒,且能溶于水,因此D中装满饱和氯化钠溶液来收集氯气;
(4)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,但是二氧化碳气体不能用碱石灰干燥;锌粒与稀硫酸在常温下制氢气不需要加热,氢气可以用浓硫酸干燥;因为二氧化锰是粉末不能放在多孔隔板上的,因此不可以;氯酸钾和二氧化锰制氧气需要加热,因此不可以,故答案为:B
(5)硫酸的质量是:49g×10%=4.9g,设氢氧化钠溶液中溶质质量分数为x,
H2SO4+2NaOH=Na2SO4+2H2O
98 80
4.9g 20g?x
=
x=20% 答:氢氧化钠溶液中溶质质量分数是20%;
故答案为:20%;
| ||
(2)B装置能起到“随开随制,随关随停”的效果,关闭玻璃旋塞,反应就停止的原因是:产生的气体不能导出,压强增大,把液体药品压回长颈漏斗,固液分离,反应停止;故答案为:产生的气体不能导出,压强增大,把液体药品压回长颈漏斗,固液分离,反应停止;
(3)在实验室里,可以在加热条件下用浓盐酸与二氧化锰反应来制取氯气(Cl2),则制取氯气应选择的发生装置是C;氯气有剧毒,且能溶于水,因此D中装满饱和氯化钠溶液来收集氯气,因为氯气的密度比氯化钠溶液的密度小,因此应该从短管进入;故答案为:C;b;氯气有剧毒,且能溶于水,因此D中装满饱和氯化钠溶液来收集氯气;
(4)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,但是二氧化碳气体不能用碱石灰干燥;锌粒与稀硫酸在常温下制氢气不需要加热,氢气可以用浓硫酸干燥;因为二氧化锰是粉末不能放在多孔隔板上的,因此不可以;氯酸钾和二氧化锰制氧气需要加热,因此不可以,故答案为:B
(5)硫酸的质量是:49g×10%=4.9g,设氢氧化钠溶液中溶质质量分数为x,
H2SO4+2NaOH=Na2SO4+2H2O
98 80
4.9g 20g?x
| 98 |
| 80 |
| 4.9g |
| 20g?x |
故答案为:20%;
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列反应属于化合反应的是( )
| A、蜡烛+氧气═二氧化碳+水 |
| B、水═氢气+氧气 |
| C、氢气+氧气═水 |
| D、锌+盐酸═氯化锌+氢气 |
 在今天的化学兴趣小组活动中,指导老师拿来了一包白色固体.老师告诉同学们说,这包白色固体可能是由Ca(OH)2和CaCO3中的一种或两种组成.为了确定该白色固体的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包白色固体.老师告诉同学们说,这包白色固体可能是由Ca(OH)2和CaCO3中的一种或两种组成.为了确定该白色固体的组成,同学们进行了如下的探究活动: