题目内容
【题目】海洋中蕴藏着丰富的化学资源,如NaCl、MgCl2、CaCl2等物质。从海水中提取金属镁的主要流程如下:
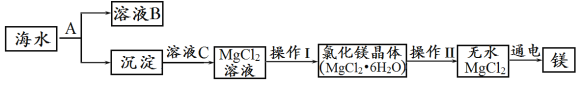
(1)电解熔融的无水MgCl2可以得到金属镁,该反应的化学方程式是__________________,
(2)将海水中的镁提取出来,首先要让海水中的镁离子形成沉淀而富集起来。为了使氯化镁 转化为沉淀,应加入的A物质是_______,反应的化学方程式是________, 溶液C是_______。
(3)操作I:蒸发浓缩、________、过滤;本化学工艺流程的副产品是___________。
【答案】MgCl2![]() Mg+Cl2↑ 氢氧化钙溶液 MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓ 稀盐酸 降温结晶 氯气
Mg+Cl2↑ 氢氧化钙溶液 MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓ 稀盐酸 降温结晶 氯气
【解析】
(1)电解熔融的无水MgCl2可以得到金属镁,该反应的化学方程式是MgCl2![]() Mg+Cl2↑。
Mg+Cl2↑。
(2)氯化镁转化为氢氧化镁,需要加入碱溶液,可以选择过量的Ca(OH)2溶液,生成氯化钙和氢氧化镁,反应的化学方程式为Ca(OH)2;MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;氢氧化镁沉淀能与稀盐酸反应生成氯化镁和水,溶液C是稀盐酸。
(3)氯化镁的溶解度受温度影响变化较大,氯化镁溶液转化为氯化镁晶体,可以采用蒸发浓缩、降温结晶、过滤的方法。
无水氯化镁分解生成镁和氯气,本化学工艺流程的副产品是氯气。
故答案为:
(1)MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)氢氧化钙溶液;MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;稀盐酸;
(3)降温结晶;氯气。

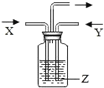
【题目】如图,将气体 X 和气体 Y 同时通入液体 Z 中,最终一定能看到液体变浑浊的是( )
X | Y | Z | 装置 | |
A | H2 | N2 | 水 |
|
B | HCl | CO2 | 澄清石灰水 | |
C | O2 | HCl | 硝酸银溶液 | |
D | O2 | CO2 | 烧碱溶液 |
A. AB. BC. CD. D
【题目】甲、乙、丙三种物质的转化关系如下图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是( )
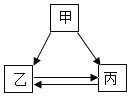
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | CuSO4 | Cu(OH)2 | CuCl2 |
D | NaOH | NaCl | NaNO3 |
A.AB.BC.CD.D