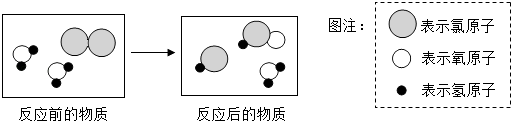
��Ŀ����
����Ŀ��ijС���ڷֽ����������������ʵ��̽�������У���С�İ���������Һ�μӵ���ʢ��5%H2O2����Һ���Թ��У������д��������ݲ�����
��������롿��������Һ�е�����������ʹ˫��ˮ�ֽ�����ʼӿ죮
���������ϡ���������Һ�к����������ӣ�H2O��SO42����Fe3+����������Һ�к����������ӣ�H2O��SO42����H+����
��ʵ����֤��ͬѧ�����ͼ1��ʾ��ʵ��������̽�����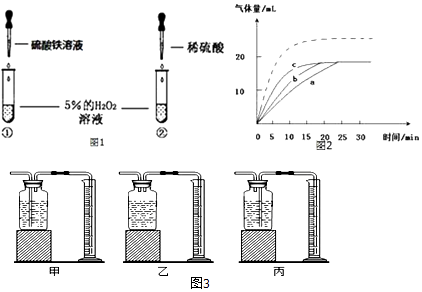
��1������ʵ������������Ƿ��������ķ�����
��2����ʵ����ۡ�����ܼӿ��������ֽ����ʵ������� �� ������
��3����ʵ����м���ϡ����������Ա仯��˵�����Ӳ�������ã�
��4�����Ҫȷ���������Ǵ���������ͨ��ʵ��ȷ�����ڻ�ѧ��Ӧǰ��� ��
��5������չ���졿
С��ͨ��ʵ�鷢�֣���������Һ��Ũ��Ҳ��Ӱ���������ֽ�����ʣ������£���a��b��c�������Թ��зֱ�������5%�����������Һ��������������ͬʱ������2��5%��10%��20%����������Һ������ʵ�����ݻ����˲��������������ʱ��仯��������ͼ2������۲���ͼ�ش����⣮
��д�����������Խ��ۣ�
����ijͬѧʵ�������õ�������ͼ��������ʾ�����Ʋ����п��ܵ�ԭ��
��6��Ϊ�ⶨ��������ֽ����������������Ӧѡ����ͼ3װ�������ţ���
��ҩƷ����ƽ�̣�ʹ�䷴Ӧ��֣�
���𰸡�
��1���Ѵ����ǵ�ľ�������Թ��У���ľ����ȼ��������
��2��H2O�������������Һ�к���ˮ����
��3��SO42��
��4�������ͻ�ѧ����û�иı�
��5����������Һ��Ũ��Խ��������ֽ������Խ����������Һ��Ũ�Ȳ���Ӱ�����ղ���������������������������ͬʱ������������Һ��Ũ�ȱ��
��6����
���������⣺��1����Ϊ����������ȼ�ԣ��ɰ�һ�������ǵ�ľ�������Թ��У���ľ����ȼ��������������Ѵ����ǵ�ľ�������Թ��У���ľ����ȼ������������2������������Һ����ˮ�������ˮ������������ã��ʲ���ȷ�����H2O���ӣ������������Һ�к���ˮ���ӣ���3�������������������Һ����ֽ����������˵�������������������Ĵ����ã����SO42������4�����ݴ�����������֪��Ҫ��ȷ���Ƿ�������������Ĵ����ã�����Ҫͨ��ʵ��ȷ���������ͻ�ѧ����û�иı�ſ��ԣ���������ͻ�ѧ����û�иı䣻��5���ٸ���ͼ���֪��������������������������Һ��Ũ���йأ�Ũ��Խ�ֽ�����Խ�죬�������ղ�������������ͬ�������������Һ��Ũ��Խ��������ֽ������Խ����������Һ��Ũ�Ȳ���Ӱ�����ղ����������������ڷ�Ӧ���Ũ��Խ��Ӧ����Խ�죬����������Խ�ࣻ���������������ͬʱ������������Һ��Ũ�ȱ��6���������ܶ�С��ˮ���ܶȣ�����Ϊ���ų�����ƿ��ˮ��������Ӧ�ö̽�����������ѡ��װ�ã��������
��1����������������ȼ������������2�����ݹ���������Һ�к���ˮ��������������3�����������к����������������������4�����ݴ�������������������5������ͼ����Ϣ��������𣻣�6�������������ܶ�С��ˮ���ܶȽ��н��