题目内容
【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质利用数字化传感器测得烧杯中溶液pH的变化图象进行相关探究。
[提出问题]它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
[实验探究1]向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液(A) | 碳酸钠溶液(B) | 氢氧化钠溶液(C) |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
[得出结论1]三种溶液的碱性由强到弱的顺序为_______________(用A、B、C表示)。
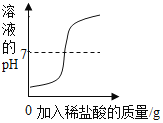
[实验探究2]甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_______变为____________色。乙同学使用一定浓度的氢氧化钠溶液和一定浓度的盐酸反应,得到pH变化与时间的关系如下图所示:
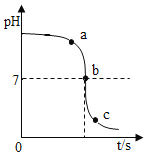
[得出结论2]①从微观角度分析,该反应的实质是_________________。
②如图所示,下列说法正确的是___________。
A.图中c点所示溶液呈碱性
B图中a点所示溶液中,含有的溶质是只有NaCl
C该实验是将氢氧化钠溶液逐滴滴入到盛有盐酸的烧杯中
D由a点到b点的pH变化过程证明酸和碱发生了中和反应
【答案】C>B>A 无色 红 氢离子和氢氧根离子结合生成水分子 D
【解析】
[得出结论1]
碳酸氢钠溶液滴加指示剂后变色为蓝色(其pH范围为7.5~9),碳酸钠溶液滴加指示剂后变色为绿色(其pH范围为10~11.9),氢氧化钠溶液滴加指示剂后变色为黄色(其pH范围为12~14),因此三种溶液的碱性由强到弱的顺序为C>B>A;
[实验探究2]
无色酚酞遇碱变红,向氢氧化钠溶液滴加无色酚酞,溶液由无色变为红色;
[得出结论2]
①氢氧化钠和盐酸反应生成氯化钠和水,从微观角度分析,该反应的实质是氢离子和氢氧根离子结合生成水分子;
②A.图中c点所示溶液的pH<7,呈酸性,故错误;
B.图中a点所示溶液的pH>7,溶液显碱性,溶液中含有的溶质是NaOH和NaCl,故错误;
C.由图象可知,溶液的pH是由大于7到等于7,最后小于7,所以该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中,故错误;
D.由a到b点的pH值的变化是从大于7逐渐的减小到等于7,可以说明酸和碱发生了中和反应,故正确。故选:D。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案