题目内容
【题目】下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)硝酸钾溶液中的溶质是__________(填化学式)。
(2)观察上述表格,可以总结出的规律是_____________。(答出一条即可)
(3)将80℃饱和的硝酸钾溶液降温到40℃,得到的是__________(填“饱和”或“不饱和”)溶液。
(4)60℃时,向50g水中加入60g硝酸钾,充分溶解后能形成硝酸钾饱和溶液的质量是_________。
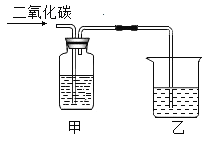
(5)如下图所示,小烧杯中盛放的是底部有未溶解的硝酸钾的溶液(20℃),若使其固体继续溶解,在大烧杯的水中可以加入的物质有___________(用字母序号表示)。
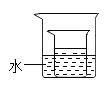
A NH4NO3 B NaCl C NaOH
【答案】KNO3 KNO3的溶解度随温度的升高而增大(合理正确即可即可) 饱和 105g C
【解析】
(1)硝酸钾溶液中的溶质是硝酸钾:KNO3。
(2)观察表格,可以总结出的规律是:KNO3的溶解度随温度的升高而增大。
(3)KNO3的溶解度随温度的升高而增大,将80℃饱和的硝酸钾溶液降温到40℃,得到的是饱和溶液。
(4)60℃时,硝酸钾的溶解度为110g,50g水中最多溶解55g硝酸钾固体,加入60g硝酸钾,有5g不能溶解,形成硝酸钾饱和溶液的质量是50g+55g=105g。
(5)小烧杯中盛放的是底部有未溶解的硝酸钾的溶液(20℃),KNO3的溶解度随温度的升高而增大,升高温度可以溶解度增大,可以使其固体继续溶解,在大烧杯的水中可以加入的物质有:
A、NH4NO3遇水吸热,温度降低;故选项错误;
B、NaCl遇水没有明显的吸、放现象,温度基本不变;故选项错误;
C、NaOH遇水放热,温度升高;故选项正确;
故选:C。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
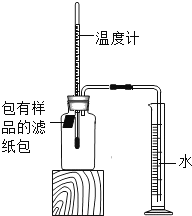
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。