题目内容
【题目】某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)
ⅰ.取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g[]
ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如下图:
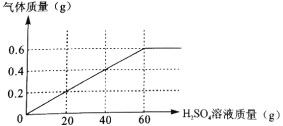
通过计算回答下列问题:
(1)过程ⅰ中生成气体的质量 g,过程ⅱ中固体充分反应后,产生气体的质量为 g。
(2)所用稀硫酸溶液的溶质质量分数为 。
(3)29g铁矿粉所含铁的氧化物中,铁元素的质量为 g,氧元素的质量为 g。
(4)该铁的氧化物化学式中,x、y的最简整数比x︰y= 。
【答案】(1)17.6;0.6 (2)49% (3)16.8;6.4 (4)3︰4
【解析】
试题分析:(1)根据铁矿粉与一氧化碳反应生成铁单质和二氧化碳,二氧化碳与烧碱反应生成碳酸钠,故生成的质量为17、6g;过程ⅱ中固体充分反应后,产生气体的质量为0.6g
(2)设所用稀硫酸的溶质的质量分数为x,需要铁的质量为Y
Fe + H2SO4 === FeSO4 + H2↑
56 98 2
Y 60×X 0.6
98/2= 60×X /0.6 56/2= Y/0.6 g
X=49% Y=16.8g
氧元素的质量为:17.6g[*32/44*1/2=6.4g
(4)该铁的氧化物化学式中,x、y的最简整数比x︰y=16.8g/56:6.4/16=3︰4

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目