��Ŀ����
����Ŀ��ͨ����ˮɹ�ο��Եõ����Ρ�ij�����г�����NaCl�⣬������MgCl2��CaCl2��Na2SO4�Լ���ɳ�����ʡ�������ij��ȤС���Ʊ����ε�ʵ�鷽����������������£�

(1)����۵�Ŀ���dz�ȥ�����е�����MgCl2��������Ӧ�Ļ�ѧ����ʽΪ_____________���������Ӧ����Ϊ__________________ ��
(2)������������߶���Ҫ�õ��IJ���������_________���ڽ��в�����ʱ�п���Ҫ�ظ����У���ԭ����_______________��
(3)�ڲ�����м���NaOH��Һ��Ŀ���dz�ȥMgCl2��������KOH��Һ���棬��ԭ����______
(4)д��NaCl��һ����;��__________��
���𰸡� MgCl2+2NaOH =Mg(OH)2+2NaCl ���ֽⷴӦ ������ ��Һ���� �������µ�����KCl ������ζƷ
����������1��������м�����������������Ȼ�þ��Ӧ������������þ�������Ȼ��ƣ�Ŀ���dz�ȥ�����е�����MgCl2��������Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH=Mg��OH��2��+2NaCl���÷�Ӧ�����ֻ�����������ɷ������������µĻ������Ӧ����Ϊ���ֽⷴӦ��
��2������١��ݡ��߷ֱ����ܽ⡢���˺�����������Ҫ�õ��IJ��������Dz��������ڽ��в�����ʱ�п���Ҫ�ظ����У���ԭ������Һ������
��3�������������������Ȼ�þ��Ӧ������������þ�������Ȼ��أ��ڲ�����м���NaOH��Һ��Ŀ���dz�ȥMgCl2�������� KOH ��Һ���棬��ԭ���ǻ������µ����� KC1��
��4��NaCl����;�кܶ࣬���磺������ζƷ����ѩ������

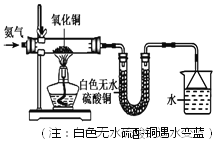
����Ŀ��ij��ѧѧϰС���������װ��(�г�װ������)������Լ����Բ���������O2������ٷ�����
(1)ʵ��ǰ��10%��H2SO4��Һ��ϴ�����������ݲ�������H2SO4��Һ��ϴ��Ŀ����__________��д���йػ�ѧ����ʽ______________________________��
(2)��֪�Թ�ʣ��ռ�͵��ܵ����Ϊ40 mL�����ܽ����ԼΪ1 cm2���γ��ȶ�Һ��ʱ����ȡ����Ϊ8.2 cm����������������������Ϊ______%��
(3)ʵ��ʱ������������������Ӧ������ʱ�ϳ�������Ӱ�����������·�����
��������衿����һ����Һ��pH��ͬ��
�������NaCl��Һ��Ũ�Ȳ�ͬ��
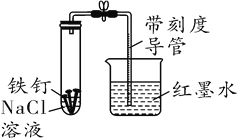
���������һ�ּ��裬��������______________________________��ͬ��
������ʵ�顿��������ʵ��װ�ã�ͨ��ȡ�����Ũ����ͬNaCl��Һ������Һ��pH���������ʵ�����ݣ�
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
Һ���߶�(cm) | 0 | 1.3 | 8.2 | 8.2 | 8.2 | 8.2 |
�γ��ȶ�Һ��ʱ��(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
��ʵ����ۡ�����ʵ�����ݷ�����Ϊ����ʵ��ⶨʱ�䣬pH����ѷ�Χ��____________��
��ʵ�鷴˼����pH��2ʱ��û�й۲쵽�ȶ�Һ���γɵ�ԭ����________________��
��ע�⣺�������ȷ�ش��������⣬������4�֣�����ѧ�Ծ��ֲܷ�����60�֡�
�������ʵ�飬̽��NaCl��Һ��Ũ�ȶ����������ʵ�Ӱ�졣
ʵ�鲽�裺 __________________________________________________________��
ʵ������________________________________________________________________��