题目内容
【题目】某校化学兴趣小组,在实验室里用二氧化锰和浓盐酸在加热条件下制取氯气并进行有关氯气性质的实验探究(如图所示)。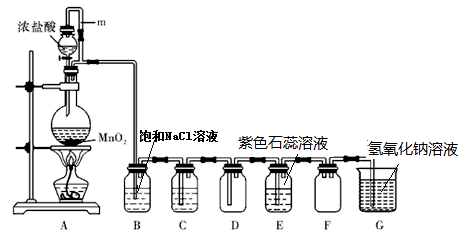
【查阅资料】
Ⅰ.氯气(Cl2)是一种黄绿色的有毒气体,能溶于水,并能与水反应:Cl2+H2O═HCl(盐酸)+HClO(次氯酸).
Ⅱ.氯气溶于水所得的溶液成为氯水,氯水除了具有消毒作用,HClO(次氯酸)还具有漂白作用.
III.稀盐酸和二氧化锰不发生反应
IV.氯气能与氢氧化钠溶液反应
回答下列问题:
(1)A 中m 管的作用是
(2)A中是制取氯气的发生装置,除生成氯气外还有氯化锰(+2价)和一种常见氧化物,请写出其化学方程式 .
(3)若进入装置D中的氯气是纯净干燥的,则装置B(饱和氯化钠溶液)的作用是 , 装置C中盛有的溶液是。
(4)装置E(石蕊溶液)颜色变化为紫色变为 , 最终变为。
(5)①装置F的作用是。
②实验装置G(氢氧化钠溶液)作用是。
③通过无数次实验和计算发现,取含溶质146克的浓盐酸和足量的二氧化锰反应,得到的氯气为 。
A.小于71克 B.等于 71克 C.大于71克 D.等于35.5克
【答案】
(1)平衡外界大气压强
(2)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)除去氯气中的HCl,浓硫酸
(4)红色,无色
(5)用作安全瓶,处理尾气,防止尾气污染空气,A
【解析】解:(1)A 中m 管可以平衡外界大气压强,保证浓盐酸顺利留下;(2)二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气和水,化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(3)饱和氯化钠溶液可以吸收并除去氯气中的氯化氢气体,同时防止氯气溶解,若进入装置D中的氯气是纯净干燥的,装置C中盛有浓硫酸起干燥作用;(4)氯气溶于水所得的溶液成为氯水,显酸性,可使紫色石蕊溶液变红色,HClO(次氯酸)还具有漂白作用,所以最终由红色变为无色;(5)①装置F是防止G中液体倒吸的安全瓶;②由于氯气有毒,所以用氢氧化钠溶液吸收氯气,防止尾气污染空气;③根据方程式146克氯化氢完全反应可得71g氯气,二氧化锰在加热条件下只能氧化浓盐酸,与稀盐酸不反应,随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完,所以产生的氯气小于71g。
MnCl2+Cl2↑+2H2O;(3)饱和氯化钠溶液可以吸收并除去氯气中的氯化氢气体,同时防止氯气溶解,若进入装置D中的氯气是纯净干燥的,装置C中盛有浓硫酸起干燥作用;(4)氯气溶于水所得的溶液成为氯水,显酸性,可使紫色石蕊溶液变红色,HClO(次氯酸)还具有漂白作用,所以最终由红色变为无色;(5)①装置F是防止G中液体倒吸的安全瓶;②由于氯气有毒,所以用氢氧化钠溶液吸收氯气,防止尾气污染空气;③根据方程式146克氯化氢完全反应可得71g氯气,二氧化锰在加热条件下只能氧化浓盐酸,与稀盐酸不反应,随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完,所以产生的氯气小于71g。
所以答案是:(1)平衡外界大气压强;(2)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(3)除去氯气中的HCl;浓硫酸;(4)红色;无色;(5)用作安全瓶;处理尾气,防止尾气污染空气;A.
MnCl2+Cl2↑+2H2O;(3)除去氯气中的HCl;浓硫酸;(4)红色;无色;(5)用作安全瓶;处理尾气,防止尾气污染空气;A.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比.

【题目】实验室常用下列装置来制取、收集气体.仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题.
(1)仪器a、c的名称是:a , c .
(2)实验室用KMnO4制取O2 , 应选用的发生装置和收集装置的组合为(填字母序号),该发生装置的不足之处是 , 该反应的化学方程式是 . 收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有(填数字序号)
①易溶于水 ②难溶于水 ③不与水反应 ④密度与空气接近 ⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入下表,并用简单的实验进行验证:
可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
原因: | 猜想的结论正确 |
(4)化学反应可控制才能更好地为人类造福,我们可以通过改变反应的条件、药品用量、改进装置等途径来达到控制反应的目的。常温下块状电石(CaC2)与水反应生成乙炔 (C2H2)气体和氢氧化钙,该反应的化学方程式是 , 实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.图中适合制取乙炔气体的发生装置有(填装置序号)。
