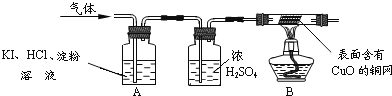
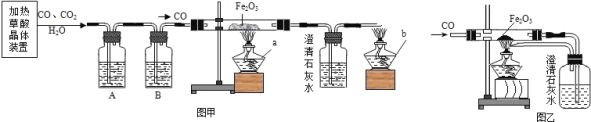
��Ŀ����
����Ŀ����1����ˮɹ�οɵõ����κͿ�±�����п�±��ʳ�ε� ������͡������͡�����Һ�������� �����ÿ�±��ʯ���飮ϡ������Ƶ�Ӧ���ڷɻ�����ҵ�Ľ���þ�����з�����Ӧ�Ļ�ѧ����ʽ�Ǣ� ���� ���� ��
��2��һ���Ӻ�ˮ�л�õĴ��Σ����к�����������ɳ�Ȳ��������ʣ��ɲ������²����ȥ �� �� ������С��Ծ��������ᴿ�Ĵ��εijɷֽ���̽�����������ν�һ���ᴿ��
̽��һ����������л���ʲô���ʣ�
���ݺ�ˮ�ijɷݺͳ����ᴿ��ʵ����������ƴ����п��ܻ���������CaCl2��MgCl2������ʵ����֤�����Ʋ⣺ȡ�����ܽ⣬��������NaOH��Һ��Ŀ���Ǽ�����û�У���ѧʽ�� ����صķ�Ӧ����ʽΪ �������ټ�������Na2CO3��Һ��Ŀ���Ǽ�������û�У���ѧʽ�� ����صķ�Ӧ����ʽΪ ��ʵ��֤������������к��е�������CaCl2��
̽���������������NaCl�����������Ƕ��٣�
�����沽���������ʵ�飺�ٳ�ȡһ����������Ʒ���ڽ���Ʒ��ˮ�ܽ��Ƴɴ�����Һ�����������Һ�м������ij���Լ������ˣ��ܳ���ϴ�Ӻ�С�ĺ�ɵõ���������A������Һ�ڽ���ijһ�����������������������õ���������B������ʵ���еõ���ij�ֹ��壮
�ڢۢݲ����У���ʹ�õ�ͬһ�����������ƣ� ���ڲ���ں͢���ʹ������������������ͬ��������Ŀ�IJ�ͬ���ڲ�����е�Ŀ���� ���ڲ�����е�Ŀ���� ��������м����Լ��ǣ���ѧʽ�� ����ط�Ӧ����ʽΪ ������ݽ��еġ�ijһ�������� ��Ŀ���� ����ط�Ӧ����ʽΪ ��������У�����Ϊ��Ҫ�����Ĺ�����A����B�� ����A��B���㲻ѡ�������һ�ֹ���������� ��
���𰸡���1���ٿ�±��ʳ�εı�����Һ��
�ڱ��ͣ�������������ʳ�ξ��壬MgCl2��Ca��OH��2=Mg��OH��2����CaCl2��
Mg��OH��2��2HCl=MgCl2��2H2O��MgCl2![]() Mg��Cl2����
Mg��Cl2����
��2���ܽ⣬���ˣ�������
̽��һ����MgCl2��2NaOH=Mg��OH��2����2NaCl��
��MgCl2��MgCl2��2NaOH=Mg��OH��2����2NaCl��CaCl2��CaCl2+Na2CO3=CaCO3��+2NaCl��
̽�����������������ٴ��ε��ܽ⣻��ֹ���ھֲ��¶ȹ��ߣ����Һ�ηɽ���Na2CO3��CaCl2+Na2CO3=CaCO3��+2NaCl��
���������������ϡ���ᣬ��ȥ������̼���ƣ�Na2CO3+2HCl=2NaCl��H2O��CO2����
A��B�к��з�Ӧ���ɵ��Ȼ��ƣ�
����������1���ٿ�±�Ǻ�ˮŨ�����κ���������Ȼ��ƺ���С���ܹ�����������50%ʱ��ˮ��Һ���ں��������У���ˮ����������ɹ����Ũ��������ʳ�Σ���±ˮ�ﵽһ��Ũ��ʱ��28.5��30�����ȣ�������ɹ�Σ���±ˮ��Ϊ��±���ʿ�±��ʳ�εı�����Һ��
�ڿ�±�Ļ�ѧʽΪMgCl2��ʯ�������Ҫ�ɷ���Ca��OH��2����������Ϊ��MgCl2��Ca��OH��2=Mg��OH��2����CaCl2��Mg��OH��2��2HCl=MgCl2��2H2O��MgCl2![]() Mg��Cl2����
Mg��Cl2����
��2�������ᴿ�IJ���Ϊ���ٰѺ�����ɳ�Ĵ�ʳ����ȫ�ܽ⣻
�ڹ��˵�������ˮ����ɳ��
��������ˮ�֣����õ��Ȼ��ƾ��壮
̽��һ������Ϊ�Ȼ�þ���������Ʒ�Ӧ����������þ���������Ȼ������������Ʒ�Ӧû�г������������ɣ��ʼ�������NaOH��Һ��Ŀ���Ǽ�����û���Ȼ�þ���Ȼ�þ���������Ʒ�Ӧ�Ļ�ѧ����ʽΪ��MgCl2��2NaOH=Mg��OH��2����2NaCl��
����ΪNa2CO3��Һ��CaCl2��Ӧ����̼��Ƴ������ʼ�������Na2CO3��Һ��Ŀ���Ǽ�������û���Ȼ��ƣ�