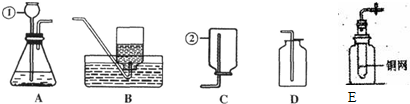
题目内容
(2011?崇明县二模)室温下,等物质的量的镁和铝分别与足量的同溶质质量分数的稀盐酸反应,产生氢气的质量(m)与反应时间(t)的关系图正确的是( )
分析:根据金属的活动性镁>铝,镁与稀硫酸反应比铝剧烈,相同时间内镁与稀硫酸反应放出氢气质量大于铝;根据金属与足酸酸反应放出=
×金属质量,等质量的镁片和铝片与足量稀硫酸反应,所放出氢气的质量大小取决于两金属的化合价与相对原子质量的比;据此可判断等质量铝完全反应放出氢气质量大量镁片.
| 金属化合价 |
| 金属的相对原子质量 |
解答:解:在金属活动性顺序中,镁>铝,由于是同相同溶质质量分数的稀盐酸反应所以与硫酸反应时镁的速率快,所用时间短,观察图象ABC均符合,排除D,
假设两种金属的质量为m,依据经验公式氢气的质量=
×金属质量,可知与足量稀盐酸完全反应放出氢气的质量分别为:
镁完全反应产生氢气的质量=
× m=
;
铝完全反应产生氢气的质量=
×m=
.
因为
<
,所以等质量镁与硫酸完全反应所产生氢气质量小于铝,排除AB,
故选C.
假设两种金属的质量为m,依据经验公式氢气的质量=
| 金属化合价 |
| 金属的相对原子质量 |
镁完全反应产生氢气的质量=
| 2 |
| 24 |
| m |
| 12 |
铝完全反应产生氢气的质量=
| 3 |
| 27 |
| m |
| 9 |
因为
| m |
| 12 |
| m |
| 9 |
故选C.
点评:根据金属活动性可判断金属与酸反应的剧烈程度;根据金属与足量酸完全反应放出氢气质量可判断,等质量的金属完全反应放出氢气质量的大小;此类问题多由这两个方面进行判断.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目