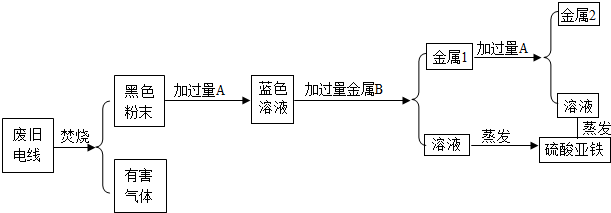
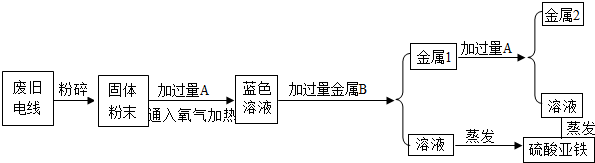
题目内容
钢铁厂购进含氧化铁(Fe2O3)85%的赤铁矿1000t.准备用这些铁矿石炼取含杂质3%的生铁.
(1)如图所示.请将求算纯铁质量的计算过程填写完整.
(2)请利用化学方程式计算生铁的质量.(反应原理为3CO+Fe2O3
Fe+3CO2)(计算结果保留整数)
(1)如图所示.请将求算纯铁质量的计算过程填写完整.

(2)请利用化学方程式计算生铁的质量.(反应原理为3CO+Fe2O3
| ||
(1)矿石中氧化铁的质量是:1000t×85%=850t,纯铁的质量是:1000t×85%×(
×100%)
故答案为:850t;1000t×85%×(
×100%)
(2)由题意得,1000t赤铁矿中含氧化铁的质量是:
1000t×85%=850t
设生成纯铁的质量为X
3CO+Fe2O3
2Fe+3CO2
160 112
850t X
=
X=595t
生铁的质量是:595t÷(1-3%)≈613t
答:生铁的质量为613t.
| 2×56 |
| 2×56+16×3 |
故答案为:850t;1000t×85%×(
| 2×56 |
| 2×56+16×3 |
(2)由题意得,1000t赤铁矿中含氧化铁的质量是:
1000t×85%=850t
设生成纯铁的质量为X
3CO+Fe2O3
| ||
160 112
850t X
| 160 |
| 112 |
| 850t |
| x |
X=595t
生铁的质量是:595t÷(1-3%)≈613t
答:生铁的质量为613t.

练习册系列答案
相关题目