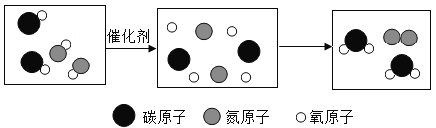
题目内容
【题目】某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4·xH2O),其主要流程如下:
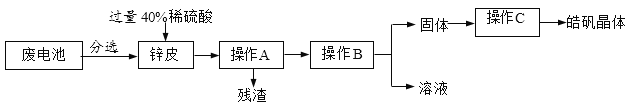
(1)配制40%的稀硫酸的步骤有:①稀释②计算③装瓶并贴标签④量取,其正确的顺序为_____(填序号)。
(2)操作A中,所用玻璃仪器有_____、玻璃棒、烧杯。
(3)操作B为蒸发浓缩、_____、过滤。
(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用_____(选填序号)。
a.热水 b.冰水 c.饱和ZnSO4溶液
【答案】②④①③ 漏斗 降温结晶 a
【解析】
(1)配制溶液的顺序为:计算、量取、稀释、装瓶并贴标签;
(2)操作A是过滤操作,所用玻璃仪器有烧杯、漏斗和玻璃棒;
(3)操作B得到的是固体和溶液,需要将溶液蒸发浓缩、降温结晶然后过滤;
(4)操作C为洗涤、低温干燥,洗涤、干燥后得皓矾晶体(ZnSO4·xH2O),故该步骤中不能用热水洗涤,否则会导致硫酸锌溶于水。

【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁元素的质量分数,小组间学进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)写出E装置中所发生反应的一个化学方程式:_____。
(3)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则_____<m<_____。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是_____。
(实验反思)
(4)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(5)该实验装置的一个明显缺陷是_____。