题目内容
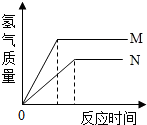 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D. 产生H2的速率N>M.
分析:等质量的M、N两种金属,活动性强的,与酸反应的速度就快,反应完用的时间就短.所以通过图表中的反应时间我们可判断M、N两种金属的活动性强弱.根据金属与酸反应产生氢气的质量公式:mH2=
×m金属我们可以比较M、N两种金属相对原子质量的大小.
| 金属在盐中的化合价 |
| 该金属的相对原子质量 |
解答:解:A、根据图表中M反应时间短,可知M的活动性比N强.故A不正确.
B、根据图表中纵坐标可知生成H2的质量M>N.故B不正确.
C、根据金属与酸反应产生氢气的质量公式:mH2=
×m金属.因为金属是等质量的,化合价又相等,所以氢气的质量越多,该金属的相等原子质量越小.故相对原子质量较大的是N.故C是正确的.
D、根据反应时间,可知产生氢气的速度M>N.故D不正确.
故选C.
B、根据图表中纵坐标可知生成H2的质量M>N.故B不正确.
C、根据金属与酸反应产生氢气的质量公式:mH2=
| 金属在盐中的化合价 |
| 该金属的相对原子质量 |
D、根据反应时间,可知产生氢气的速度M>N.故D不正确.
故选C.
点评:该题考查了学生观察图表的能力,要求学生会根据图表判断金属的活动性,生成氢气质量的多少,反应速度的快慢,金属相对原子质量的大小.掌握住根据金属与酸反应产生氢气的质量公式.对以后的解题很有帮助.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 18、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
18、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( ) 20、等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.
20、等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示. 46、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,请回答:
46、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,请回答: 等质量的M、N两种金属,分别与足量的相同浓度的稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述中正确的是( )
等质量的M、N两种金属,分别与足量的相同浓度的稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述中正确的是( )