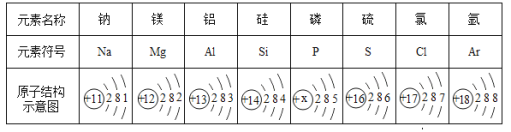
题目内容
【题目】某化学实验小组探究碱的化学性质.
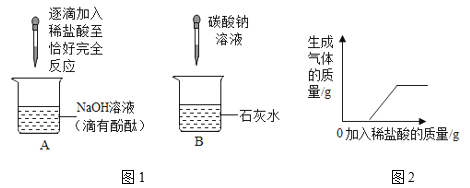
(1)A实验的现象是_______________________;
(2)B实验中发生的化学反应方程式为_____________________;
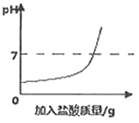
(3)实验结束后将所有物质倒入同一个废液缸中,发现底部有沉淀,上层溶液呈红色,取上层红色溶液加入过量的稀盐酸,根据反应现象得到了如图所示的实验现象.
①加入稀盐酸后产生的气体是___________;
②废液缸中上层红色溶液中含有的溶质是_______________________.
【答案】滴有酚酞的氢氧化钠溶液变为无色 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 二氧化碳 氢氧化钠和碳酸钠
【解析】
(1)当盐酸恰好和氢氧化钠溶液反应时,生成的氯化钠呈中性,A实验的现象是滴有酚酞的氢氧化钠溶液变为无色;
(2)B实验中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)①分析图像数据得出,加入稀盐酸时先和氢氧化钠反应,氢氧化钠完全反应后,产生气体,说明溶液中含有碳酸钠,碳酸钠和稀盐酸反应生成二氧化碳、氯化钠和水,则气体是二氧化碳;
②分析图像数据得出溶液中一定存在氢氧化钠和碳酸钠,溶液中含有碳酸钠时,一定不含有氢氧化钙,这是因为碳酸钠和氢氧化钙不能共存,因此废液中使酚酞溶液变红的物质一定是氢氧化钠和碳酸钠。废液缸中上层红色溶液中含有的溶质是氢氧化钠和碳酸钠。

练习册系列答案
相关题目