题目内容
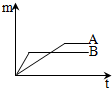 将质量相等的A、B两块金属,分别放入同种的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中A、B两种元素的化合价相同).
将质量相等的A、B两块金属,分别放入同种的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中A、B两种元素的化合价相同).(1)分析如图,可以获得的信息有(任写两条):①
(2)A或B可能是铜吗?为什么?
(3)如果金属B是锌,符合A、B关系金属A可能是
考点:金属的化学性质
专题:金属与金属材料
分析:在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,金属的位置越靠前,反应的速度越快,单位时间内生成的氢气越多;等质量的金属和酸完全反应时产生氢气的质量=金属的化合价/金属的相对原子质量×参加反应的金属质量.
解答:解:(1)根据坐标可以发现,单位时间内B产生的氢气比A多,故B的反应速度快,说明B比A活泼;A、B两种元素的化合价相同,且质量相等的A、B两块金属完全A产生的氢气比B多,因此A的相对原子质量比B小;故填:B比A活泼;B的相对原子质量比A大(合理即可);
(2)A或B不可能是铜,因为铜位于氢后,不能反应;故填:不可能;因为铜位于氢后,不能反应;
(3)B的活动性强,且相对原子质量大,则A的活动性比锌弱,且相对原子质量小,若金属B是锌,则A可能是铁,故填:铁(合理即可).
(2)A或B不可能是铜,因为铜位于氢后,不能反应;故填:不可能;因为铜位于氢后,不能反应;
(3)B的活动性强,且相对原子质量大,则A的活动性比锌弱,且相对原子质量小,若金属B是锌,则A可能是铁,故填:铁(合理即可).
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行分析.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
金秋十月,人们站在桂花树旁常能闻到怡人的桂花香,这一现象说明了( )
| A、分子很大 |
| B、分子分裂成原子 |
| C、分子在不断地运动 |
| D、分子之间有间隔 |