题目内容
【题目】我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L。
(1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g。
(2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。
【答案】C
【解析】
(1)二氧化碳的质量m=ρV=2.2g.
(2)设碳酸钙的质量为x,生成的氯化钙的质量为y,
则CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
x y 2.2g
100:x ="111:y" ="44:2.2g" ,
解得x=5g,y=5.55g,
该样品中碳酸钙的质量分数为![]() ×100%=66.7%,
×100%=66.7%,
(3)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为7.5g+34.7g-2.2g=40g,溶质的质量为5.55g,则溶质的质量分数为![]() ×100%=14.8%,
×100%=14.8%,

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
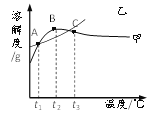
A. 甲为NH4Cl
B. t3℃应介于40℃~50℃
C. 乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D. 甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
【题目】某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么?
[查阅资料](1)氢氧化钙能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图:
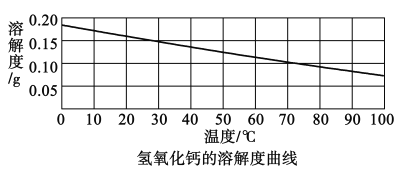
[猜想假设]猜想一:Ca(OH)2
猜想二:__________
猜想三:CaCO3
[实验验证]
实验操作 | 实验现象 | 实验结论 |
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 | 烧杯底部有较多固体未溶解 | 样品中含有CaCO3 |
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2~3滴无色酚酞试液 | _____________ | 样品中含有Ca(OH)2 |
[得出结论]甲同学认为猜想二正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,他认为猜想_____也可能正确,原因是______。
(2)丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有_______,则猜想二正确。
[拓展提升]要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否________________。