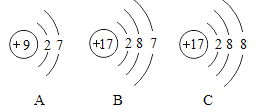
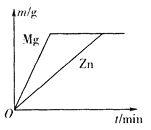
题目内容
【题目】某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
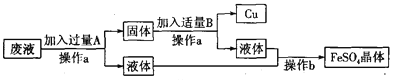
(1)操作a、b的名称分别是_______、_______。
(2)写出流程中有关反应的化学方程式:_______、_______。以上两个反应能够发生的原因是____________________________________________________。
【答案】 过滤 蒸发 Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑ 在金属活动性顺序中,铁位于铜、氢之前
【解析】根据在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,所以要回收铜得到硫酸亚铁,可以加入铁进行分析。解:(1)、经过操作a能得到固体和液体,所以a操作为过滤;液体经过操作b得到了硫酸亚铁晶体,所以操作b是蒸发;(2)、加入过量A时的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;加入适量B时的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑;以上两个反应能够发生的原因是:在金属活动性顺序中,铁位于铜、氢之前。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】根据下表回答问题.
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度 | A | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
B | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
(1)20℃时,将20gA放入盛有50g水的烧杯中,充分溶解后,所得溶液的质量为_______g.
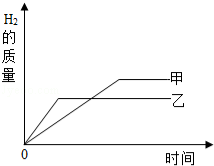
(2)50℃时,将等质量的A、B分别放入100g水里,充分溶解后,如图所示.
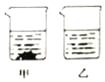
①烧杯_____(填“甲”或“乙”)中的溶液一定是饱和溶液.
②乙中的溶质是______(填“A”或“B”).
③若使甲中固体完全溶解,所得溶液中溶质的质量分数_________(填“一定变大”、“一定变小”、“一定不变”或“不确定”).