题目内容
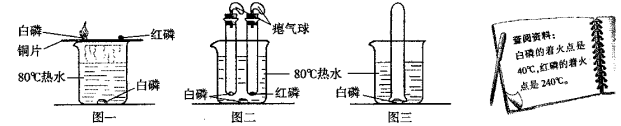
【题目】为了探究燃烧的条件,某兴趣小组的同学设计如下实验:实验装置如下图所示,在250 mL烧杯中,注入200 mL热水,并投入一小块白磷,烧杯口盖上薄铜片,铜片一端放一小块已用滤纸吸干水的白磷,另一端放一小堆红磷(白磷的着火点为40℃,红磷的着火点为200℃)。不一会儿,观察到:
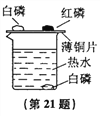
(1)铜片上的白磷燃烧起来,这是因为白磷具有_______,温度达到_______且又与_______接触。铜片上的红磷不燃烧,这是因为红磷虽然与_______接触,但温度没有达到_______。水中的白磷不燃烧,这是因为水中白磷温度虽超过_______,却不与_______接触。
(2)若铜片上白磷的量比较多,燃烧一段时间后,铜片上的红磷也会燃烧起来,为什么?__________________________________________。
(3)白磷燃烧应该出现的现象是什么?____________________________。
(4)若将烧杯上的铜片移走,并用一根玻璃导管对着水中的白磷吹入空气。你将观察到什么现象?为什么?___________________________________。
【答案】 可燃性 着火点 氧气 氧气 着火点 40℃ 氧气 白磷燃烧放出热量,使温度达到了红磷的着火点 放出热量,产生大量的白烟 水中白磷燃烧,白磷与氧气接触且温度达到了白磷的着火点
【解析】(1)铜片上的白磷能够燃烧,是因为具备了物质燃烧的条件:①物质具有可燃性.②可燃物与氧气接触.③达到可燃物的着火点;而红磷虽与氧气接触,但由于红磷的着火点高,温度未到到着火点,故不能燃烧;水中的白磷不燃烧,这是因为水中白磷温度虽超过着火点,却不与氧气接触。(2)白磷量比较多,燃烧一段时间后铜片以及红磷周围的温度升高,达到了红磷的着火点.红磷又与氧气接触,符合物质燃烧的条件.所以红磷也燃烧了起来;燃烧的方程式为:4P+5O2![]() 2P2O5;(3) 白磷燃烧应该出现的现象是:剧烈燃烧,放出大量热,产生大量白烟;(4)水中的白磷开始不能燃烧,就是因为没与氧气接触.现在用导管对着水中的白磷吹入空气,可以看到白磷在水中燃烧,因为热水中的温度超过了白磷的着火点,吹入空气,使白磷与空气中的氧气接触,满足了白磷燃烧的条件;燃烧的现象为:发出黄光,产生大量白烟。
2P2O5;(3) 白磷燃烧应该出现的现象是:剧烈燃烧,放出大量热,产生大量白烟;(4)水中的白磷开始不能燃烧,就是因为没与氧气接触.现在用导管对着水中的白磷吹入空气,可以看到白磷在水中燃烧,因为热水中的温度超过了白磷的着火点,吹入空气,使白磷与空气中的氧气接触,满足了白磷燃烧的条件;燃烧的现象为:发出黄光,产生大量白烟。

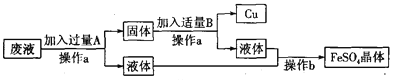
【题目】学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白.
【提出问题】氧化铝能不能作过氧化氢分解的催化剂呢?
【作出猜想】氧化铝能作过氧化氢分解的催化剂.
【实验验证】
实验步骤 | 实验现象 | 实验结论 | |
实验一 | _______________ | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
实验二 | 在装有过氧化氢溶液的试管中加入少量氧化铝,然后将带火星的木条伸入试管中 | ________ | 氧化铝能加快过氧化氢的分解速率 |
【得出结论】氧化铝能加快过氧化氢的分解速率,故氧化铝能作过氧化氢分解的催化剂.
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明氧化铝能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
【实验目的】探究_______________________________________ 。
【实验步骤】①准确称量氧化铝(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行__________,洗涤,干燥,称量;④对比反应前后氧化铝的质量.
【交流讨论】如果氧化铝在反应前后质量不变,则说明氧化铝可以作过氧化氢分解的催化剂.
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究_____________________________________ 。
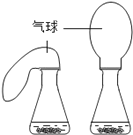
【拓展探究】设计如下四组实验,比较二氧化锰和氧化铝对过氧化氢溶液分解的催化作用,其中观察效果最差的_________
|
|
|
|
第一组 | 第二组 | 第三组 | 第四组 |
A.第一组同时实验,观察比较反应过程中两个气球体积的变化
B.第二组同时实验,观察比较反应过程中两个试管内产生气泡的快慢
C.第三组分两次实验,看木条是否能复燃
D.第四组分两次实验,比较收集一定体积的气体所需要的时间