题目内容
【题目】(4分)请根据下图所示的实验过程和提供的数据,回答以下问题。
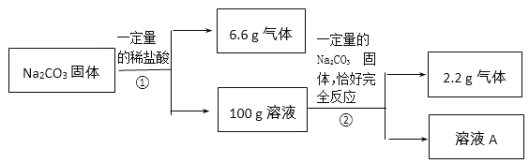
(1)100g溶液中含有的溶质有(用化学式表示) 。
(2)计算所得溶液A的溶质质量分数(写出计算过程,原子相对质量Na:23 C:12 O:16)。
【答案】(1) NaCl、 HCl ;
(2)22.7%
【解析】
试题分析:(1)碳酸钠与盐酸反应生成的是氯化钠、水和二氧化碳,故图示可知第一次反应后的溶液中再加入碳酸钠还生成了二氧化碳气体,那么水面盐酸是过量的,即100g溶液中含有的溶质有两种:NaCl、 HCl;
(2)所得溶液A的溶质中的溶质是氯化钠,但氯化钠来自两个部分,即两次反应生成的氯化钠,利用化学方程式,根据两次反应生成的二氧化碳的质量即可计算出生成的氯化钠的质量和参加反应的碳酸钠的质量。
解:设溶液A中氯化钠的质量为x。 设②中加入的碳酸钠的质量为y。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
117 44 106 44
x 8.8g y 2.2g
117/44=x/8.8g 106/44=y/2.2g
x = 23.4 g y==5.3g
m(溶液A) = 100 g + 5.3 g – 2.2 g = 103.1 g
溶液A中NaCl的质量分数==![]() ×100%==22.7%
×100%==22.7%
答:略。

练习册系列答案
相关题目