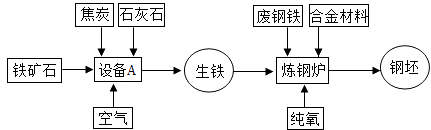
��Ŀ����
����Ŀ��ij������ȤС���һ������Ʒ���������ʣ����ʲ�����ˮ��Ҳ����ϡ���ᷴӦ�����з������ס��ҡ�����λͬѧ�ֱ����ʵ�飬����ֻ��һλͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ��ʵ���������±���
�� | �� | �� | |
�ձ�+ϡ���� | 200g | 150g | 150g |
���������Ʒ | 9g | 9g | 14g |
��ַ�Ӧ���ձ�+ʣ���� | 208.7g | 158.7g | 163.7g |
��������������ݣ��ش��������⣺���ձ�������Ϊ25.4g����������ȷ��1%��
��1����λͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫӦ��
��2��������Ʒ����������������
��3������ǡ����ȫ��Ӧ��������Һ�����ʵ�����������
���𰸡�
��1���⣺�ס��ұȽ�˵��9g����Ʒ��ȫ��Ӧ�ܲ���0.3g�������ҡ����Ƚ�˵��150gϡ������ȫ��Ӧ����0.3g��������˿����ж���ͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ
����ͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫӦ
��2���⣺��������������Ϊ��150g+9g��158.7g=0.3g
��Fe������Ϊx��FeSO4������Ϊy
Fe+H2SO4�T | FeSO4+ | H2�� |
56 | 152 | 2 |
x | y | 0.3g |
![]()
��ã�x�T8.4g��y=22.8g
��Ʒ��������������Ϊ�� ![]() ��100%=93%
��100%=93%
����Ʒ��������������Ϊ93%
��3���⣺������Һ�����ʵ���������Ϊ�� ![]() ��100%�T17%
��100%�T17%
��ǡ����ȫ��Ӧ��������Һ�����ʵ���������Ϊ17%
����������1���ס��ұȽ�˵��9g����Ʒ��ȫ��Ӧ�ܲ���0.3g�������ҡ����Ƚ�˵��150gϡ������ȫ��Ӧ����0.3g��������˿����ж���ͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ����2�������������������������ᷴӦ�Ļ�ѧ����ʽ���Լ������Ʒ�������������������������������������3�������������������������ᷴӦ�Ļ�ѧ����ʽ���Լ������Ӧ�����ɵ��������������������������ǡ����ȫ��Ӧ��������Һ�����ʵ�����������
�����㾫����������Ŀ����֪���������ø��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ո����ʼ�������=ϵ������Է�������֮�ȣ�

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�����Ŀ����ѧ�������������ᷢչ�����˾��ס����ж�ijһ����֪ʶ���ɶ���ȷ��һ����
A�����ʶ | B�����ʼ��� |
��������һһ�������� ����ȱпԪ��һһ��״���״� | ͭƬ����Ƭһһ�۲���ɫ ������һһ �ô����� |
C����ȫ��ʶ | D���������� |
�������Ż�һһ���Ը��Ϲ������ �����̺ܴ�ʱһһ��ʪë����ס�ڱ� | ���ٰ�ɫ��Ⱦһһ��ʹ��������Ʒ ����������Ⱦһһ��ʹ�û�ʯȼ�� |
A. A B. B C. C D. D