��Ŀ����
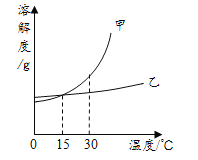
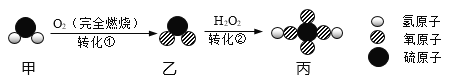
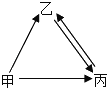
����Ŀ���ס��ҡ����������ʾ����ؿ��к�������Ԫ�أ��ס��������Ԫ����ͬ�Ļ�������ǵ��ʣ��ס����ڳ����¾�ΪҺ�壬��һ�������¾��ɷֽ�ɱ�������֮������ͼ��ʾ��ת����ϵ���������ʺͷ�Ӧ�����Ѿ���ȥ����
��1���Ļ�ѧʽΪ________��
��2���ɱ������ҵĻ�ѧ����ʽΪ____________________��������Ӧ����Ϊ________��
��3�����۵ĽǶȽ��ͼס��������������в����ԭ����_____________________________��
���𰸡�H2O2 2H2+O2![]() 2H2O ���Ϸ�Ӧ ���ӹ��ɲ�ͬ
2H2O ���Ϸ�Ӧ ���ӹ��ɲ�ͬ
��������
���ݵؿ��к�������Ԫ��Ϊ��Ԫ�أ��ס��ҡ����������ʾ����ؿ��к�������Ԫ�أ��������������о�������Ԫ�أ��ס��������Ԫ����ͬ�Ļ�������ǵ��ʣ��ס����ڳ����¾�ΪҺ�壬��һ�������¾��ɷֽ�ɱ��������ҿ��Ի���ת�������Լ��ǹ���������Һ������ˮ������������Ȼ���Ƴ������ʽ�����֤���ɡ�
��1���ؿ��к�������Ԫ��Ϊ��Ԫ�أ��ס��ҡ����������ʾ����ؿ��к�������Ԫ�أ��������������о�������Ԫ�أ��ס��������Ԫ����ͬ�Ļ�������ǵ��ʣ��ס����ڳ����¾�ΪҺ�壬��һ�������¾��ɷֽ�ɱ��������ҿ��Ի���ת�������Լ��ǹ���������Һ������ˮ������������������֤���Ƶ���ȷ�����Լ���H2O2��
��2���ɱ������ҵķ�Ӧ�������������ڵ�ȼ������������ˮ����ѧ����ʽΪ��
2H2+O2![]() 2H2O���÷�Ӧ������������������һ�����ʵĻ��Ϸ�Ӧ��
2H2O���÷�Ӧ������������������һ�����ʵĻ��Ϸ�Ӧ��
��3�����ʵ���ɺͽṹ�������ʵ����ʣ���Ϊ��������H2O2����ΪˮH2O�������ʵ����Ԫ����ͬ���������ʵķ��ӽṹ��ͬ�����������ʵ������в��졣