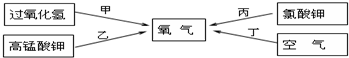
题目内容
某同学做了如下家庭小实验:在一个玻璃杯中放入了大半杯白醋,并将一只洗净后的小鸡蛋轻放入玻璃杯中,可观察到鸡蛋慢慢沉到杯底,慢慢又浮起来,马上又沉下,…这样反复运动.请你通过化学和物理等知识来解释该实验现象.
考点:酸的化学性质
专题:常见的酸 酸的通性
分析:醋酸属于弱酸,但也具备酸的共性,与碳酸盐反应会生成二氧化碳,鸡蛋壳中有碳酸钙等物质与醋酸反应会生成二氧化碳.
解答:答:醋酸具备酸的共性,与鸡蛋壳中的碳酸盐反应会生成二氧化碳,开始附着在蛋壳表面使鸡蛋上浮,到达液面后,气体溢出,鸡蛋就会下沉.如此反复.
点评:此题是对醋酸的酸性进行的考查,解题的关键是利用醋酸的酸性完成,从化学性质的角度分析主要是利用了酸与碳酸盐发生的反应生成了二氧化碳.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下列四个坐标图分别表示四个实验过程中某些量的变化,其中能正确反映其对应操作中各量变化关系的是( )
A、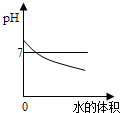 向pH=12的氢氧化钠溶液中不断加水 |
B、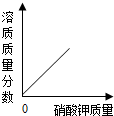 向接近饱和的硝酸钾溶液中不断加入硝酸钾固体 |
C、 加热一定质量的高锰酸钾 |
D、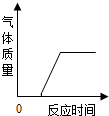 在部分变质的NaOH溶液中加稀盐酸 |

 小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是
小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是