题目内容
为测定一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水,得到200g溶液,再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请计算或回答:(1)反应产生的CO2的质量为______g.
(2)若所取样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)现有质量相等的烧碱三份,放置一定时间后,若一份未变质、一份部分变质、一份全部变质(注:变质后的物质都为Na2CO3),当分别与相同质量分数的硫酸充分反应时,需要硫酸的质量相等.其原因是______.
【答案】分析:(1)利用质量守恒定律,根据反应前后物质总质量的差可计算放出二氧化碳的质量;
(2)利用完全反应放出二氧化碳的质量,根据反应的化学方程式,可计算出样品中碳酸钠的质量,由样品质量与碳酸钠质量的差与样品质量相比,求出样品中NaOH的质量分数;
(3)根据反应前后元素质量不变,变质的氢氧化钠中钠元素质量不变,与硫酸反应后可生成相同质量的硫酸钠,而硫酸钠中硫酸根全部来自于所加入的稀硫酸,因此,可得到三份样品消耗等量稀硫酸的结论.
解答:解:(1)根据质量守恒定律,反应产生的CO2的质量=200g+200g-395.6g=4.4g
故答案为:4.4;
(2)设所取样品中含有Na2CO3的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
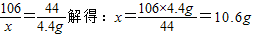
样品中NaOH的质量分数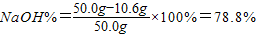
答:烧碱样品中NaOH的质量分数为78.8%
(3)根据反应前后元素质量不变,变质的氢氧化钠中钠元素质量不变,与硫酸反应后可生成相同质量的硫酸钠,则含有等量的硫酸根,而硫酸钠中硫酸根全部来自于所加入的稀硫酸,因此,所加稀硫酸的质量也相等;
故答案为:依据钠元素质量守恒关系,氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,同时消耗98g硫酸.
点评:根据质量守恒定律计算出反应所放出二氧化碳的质量是解决本题的起点.
(2)利用完全反应放出二氧化碳的质量,根据反应的化学方程式,可计算出样品中碳酸钠的质量,由样品质量与碳酸钠质量的差与样品质量相比,求出样品中NaOH的质量分数;
(3)根据反应前后元素质量不变,变质的氢氧化钠中钠元素质量不变,与硫酸反应后可生成相同质量的硫酸钠,而硫酸钠中硫酸根全部来自于所加入的稀硫酸,因此,可得到三份样品消耗等量稀硫酸的结论.
解答:解:(1)根据质量守恒定律,反应产生的CO2的质量=200g+200g-395.6g=4.4g
故答案为:4.4;
(2)设所取样品中含有Na2CO3的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
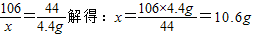
样品中NaOH的质量分数
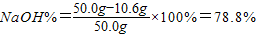
答:烧碱样品中NaOH的质量分数为78.8%
(3)根据反应前后元素质量不变,变质的氢氧化钠中钠元素质量不变,与硫酸反应后可生成相同质量的硫酸钠,则含有等量的硫酸根,而硫酸钠中硫酸根全部来自于所加入的稀硫酸,因此,所加稀硫酸的质量也相等;
故答案为:依据钠元素质量守恒关系,氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,同时消耗98g硫酸.
点评:根据质量守恒定律计算出反应所放出二氧化碳的质量是解决本题的起点.

练习册系列答案
相关题目