题目内容
【题目】有一包白色粉末可能由NaOH、Na2SO4、CuSO4、Na2CO3和BaCl2中的几种组成,为确定其成分,现做如下实验: ①取适量该粉末于试管,加足量的水溶解.过滤,得到沉淀和无色溶液.
②向沉淀中加入过量稀硝酸,沉淀部分溶解且无气泡产生.
则原粉末中一定有;一定没有;②中沉淀溶解的化学方程式为;①中无色溶液中一定含有的溶质是 .
③为证明可能存在的物质是否一定存在,另取①中沉淀5.64g做如下实验: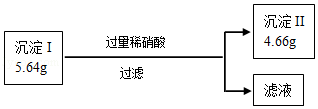
请根据以上数据分析,该物质存在.
A、一定 B、一定不 C、无法确定.
【答案】氢氧化钠、硫酸铜、氯化钡;碳酸钠;Cu(OH)2+2HNO3=Cu(NO3)2+2H2O;氯化钠;C
【解析】解:硫酸铜和氢氧化钠反应会生成溶于酸的氢氧化铜沉淀,碳酸钠和氯化钡反应生成碳酸钡沉淀和酸反应会生成二氧化碳气体,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,所以①取适量该粉末于试管,加足量的水溶解.过滤,得到沉淀和无色溶液,②向沉淀中加入过量稀硝酸,沉淀部分溶解且无气泡产生,所以粉末中一定不含碳酸钠,一定含有氯化钡、氢氧化钠、硫酸铜,硫酸铜中也会提供硫酸根离子,所以不能确定是否含有硫酸钠,所以原粉末中一定有氢氧化钠、硫酸铜、氯化钡,一定没有碳酸钠,②中沉淀溶解的反应是氢氧化铜和硝酸反应生成硝酸铜和水,化学方程式为:Cu(OH)2+2HNO3=Cu(NO3)2+2H2O,①中无色溶液中一定含有的溶质是氯化钠; 另取①中沉淀5.64g做如下实验,加入过量的稀硝酸,得到沉淀4.66g,溶解的氢氧化铜沉淀质量是0.98g,没有样品的质量,所以不能判断样品中是否含有硫酸钠,故选:C.
所以答案是:氢氧化钠、硫酸铜、氯化钡,碳酸钠,Cu(OH)2+2HNO3=Cu(NO3)2+2H2O,氯化钠;C.
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案