题目内容
(2006?昆明)工业上常用电解纯净的饱和食盐水来制烧碱.将制得的烧碱溶液再经浓缩、蒸发等步骤制成固体烧碱.我们知道,原料往往不能全部转化为烧碱(NaOH);另外,如果固体烧碱长时间在仓库放置,表面可能会有Na2CO3杂质生成.
(1)现从仓库中取来烧碱样品,请你推断,该烧碱样品中除可能含Na2CO3杂质外,还可能含有的另一种杂质是
(2)要检测样品中可能含有的这两种杂质,请完成设计的下列实验方案.
(1)现从仓库中取来烧碱样品,请你推断,该烧碱样品中除可能含Na2CO3杂质外,还可能含有的另一种杂质是
NaCl
NaCl
(水不作为杂质考虑);(2)要检测样品中可能含有的这两种杂质,请完成设计的下列实验方案.
| 实验步骤 | 实验现象 | 结论 |
| ①取少量样品于试管中并加入过量的稀HNO3 | 有气泡 有气泡 |
存在Na2CO3 存在Na2CO3 |
| ②再向实验①的溶液中加入AgNO3溶液 | 白色沉淀 白色沉淀 |
含有NaCl 含有NaCl |
分析:根据已有的知识进行分析,制取氢氧化钠使用的氯化钠溶液,故可能含有氯化钠,氢氧化钠能与二氧化碳反应生成碳酸钠,要检验碳酸钠使用的是加酸化气的方法,检验氯化钠使用的加入硝酸银溶液观察是否有沉淀产生.
解答:解:(1)制取氢氧化钠使用的是氯化钠溶液,故还可能含有氯化钠,故填:NaCl;
(2)要检验含有碳酸钠,可以使用加酸化气的方法,由于需要检验氯化钠的存在,所以使用的酸可以是稀硝酸,不能使用盐酸或稀硫酸,加入过量的稀硝酸将含有的碳酸钠全部除去,加入硝酸银溶液观察是否有沉淀产生,确定氯化钠的存在,故填:
现象 结论
有气泡 存在Na2CO3
白色沉淀 含有NaCl
(2)要检验含有碳酸钠,可以使用加酸化气的方法,由于需要检验氯化钠的存在,所以使用的酸可以是稀硝酸,不能使用盐酸或稀硫酸,加入过量的稀硝酸将含有的碳酸钠全部除去,加入硝酸银溶液观察是否有沉淀产生,确定氯化钠的存在,故填:
现象 结论
有气泡 存在Na2CO3
白色沉淀 含有NaCl
点评:本题考查了常见物质的确定的实验设计,完成此题,可以依据物质的性质进行.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
 (2006?贵阳)金属是一类重要的材料,人类生产、生活都离不开金属.下面是小明同学对铁的部分知识的学习、探究.
(2006?贵阳)金属是一类重要的材料,人类生产、生活都离不开金属.下面是小明同学对铁的部分知识的学习、探究.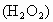 既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
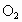 .若配制5%的双氧水600g,需30%的双氧水的质量为________;
.若配制5%的双氧水600g,需30%的双氧水的质量为________;
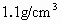 )与水的体积比为________.
)与水的体积比为________.