题目内容
【题目】过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2+H2SO4=BaSO4↓+H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
【答案】(1)16.9g (2)6.8% (3)63.3g
【解析】
(1)设加入BaO2的质量为x,生成的H2O2质量为y。
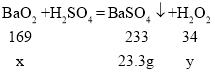
![]() x=16.9g,
x=16.9g,
![]() y=3.4g,
y=3.4g,
(2)反应后所得溶液中溶质质量分数= ![]() ×100% = 6.8%;
×100% = 6.8%;
(3)设需加入水的质量为z,则(16.9+56.4-23.3)×6.8% =(50+z)×3% ,z=63.3g;
答:(1)加入BaO2的质量为16.9g;
(2)反应后所得溶液中溶质质量分数为6.8%;
(3)需加入水的质量为63.3g。

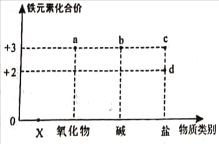
【题目】化学规律建立在实验基础之上,质量守恒定律可以用许多化学实验加以验证。

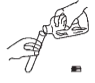
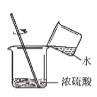
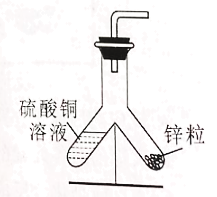
(1)小东同学按照课本上的实验进行验证(如图所示)。一段时间后,可以观察到铁钉表面出现_____,其反应的化学反应方程式为__,反应前后天平读数不变,但溶液颜色变化不明显。
(2)小东想既能验证质量守恒定律,又能更快地观察到溶液颜色的变化,提出了以下设想:
(提出设想)设想一:增大硫酸铜溶液的浓度
设想二:用更活泼的金属锌代替铁钉
(实验验证)小东将以上实验进行了如下改进:
实验内容 | 实验现象 | |
实验1 | 烧杯中换成饱和硫酸铜溶液 | ①几小时后溶液颜色几乎不变 ②天平读数不变 ③铁钉表面有变化 |
实验2 | 铁钉换成锌粒 | ①溶液颜色明显变浅 ②天平读数减小 ③锌粒表面有变化 |
(实验分析)(3)从以上现象分析,两个设想都不合适,其中按设想_____(填“一”或“二”)进行的实验能够验证质量守恒定律。
(4)实验1中溶液颜色几乎不变的原因可能是_____(填序号)。
A 铁与饱和硫酸铜溶液不反应
B 铁表面形成了一层氧化膜,阻止了反应的进一步进行
C 生成的铜快速沉积在铁表面,阻止了反应的进一步进行
D 水也参与了该反应,但饱和硫酸铜溶液中水太少
(5)实验2虽然很快观察到溶液颜色变化,但出现了反应后总质量减小的情况,老师提醒小东,硫酸铜溶液呈酸性,所以总质量减小的原因可能是____。
(6)小东通过反复实验和探究得出:向实验1的饱和硫酸铜溶液中加入等体积的水,将实验2中的烧杯换成如图所示装置,均能达到实验目的,但该装置中缺少一种物品,请你在装置图中画出____。
【题目】有一种管道疏通剂,主要成分为铝粉和氢氧化钠粉末。工作原理是:利用铝和氢氧 化钠遇水反应放出大量的热加快氢氧化钠对油脂和毛发等淤积物的腐蚀,同时产生气体 增加管道内气压,利于疏通。
(查阅资料)铝、氢氧化钠和水反应生成偏铝酸钠(NaAlO2)和一种气体单质。NaAlO2易溶于水,其水溶液呈碱性。
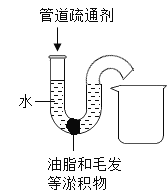
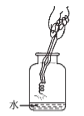
实验一 :小明用如图所示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明从左端管口加入管道疏通剂, 然后用胶塞堵住弯管左端上口,可能出现的现象为 __________ (填字母序号)。
A 产生大量气体
B 弯管内温度升高
C 堵塞物变软被气体赶出,落入烧杯中
写出铝、氢氧化钠、水反应的化学方程式 _________________________。
实验二:为了证明烧杯中废液里是否还含有氢氧化钠,小明做了如下实验:
实验操作 | 实验现象 | 实验结论 |
取少量澄清废液于试管中, 滴入酚酞 | 溶液变红 | 废液中有氢氧化钠 |
小红对小明的结论提出了质疑,理由是___________________。
小红提议把酚酞改为 CuSO4 进行实验,可以得出废液中还含有氢氧化钠。其理由是_______(写化学方程式)。