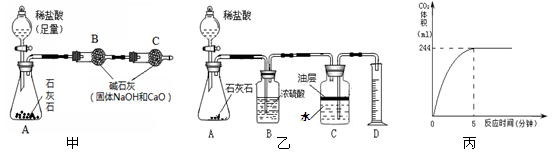
题目内容
(6分)韩国“岁月号”沉船事故发生后,几百名潜水员参与了打捞工作,他们携带的水下供氧设备中供氧剂是过氧化钠(Na2O2),它与人呼出的二氧化碳及水蒸气反应生成氧气供人呼吸.某同学想进一步探讨过氧化钠与水的反应(2Na2O2+2H2O═4NaOH+O2↑),将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生.请计算:
(1)反应生成的氧气质量;
(2)反应后所得溶液中溶质的质量分数.
3.2g; 10%
解析试题分析:已知量:过氧化钠15.6g,过量水147.6g,过氧化钠与水反应的化学方程式;未知量:生成的氧气质量;生成的氢氧化钠质量;所得溶液的溶质质量分数;解题思路:可根据过氧化钠与水反应的化学方程式求得生成的氧气和氢氧化钠的质量;进而利用质量守恒定律求得所得溶液的质量,及所得溶液的溶质质量分数;具体过程如下:
解:(1)设生成的氧气的质量为x,生成的氢氧化钠的质量为y,
2Na2O2+2H2O=4NaOH+O2↑
156 160 32
15.6g y x
X=3.2g y=16g
(2)所得溶液的质量为147.6g+15.6g-3.2g=160g
所得溶液的溶质质量分数为 ×100%=10%
×100%=10%
答:(1)反应生成的氧气的质量为3.2g,(2)所得溶液的溶质质量分数为10%
考点:化学方程式的计算;质量守恒定律的应用

 阅读快车系列答案
阅读快车系列答案取一定量氧化钙和氢氧化钙组成的混合物加入到800g水中使其完全溶解,再向该溶液中通入适量的二氧化碳气体,至固体质量恰好不再增加,过滤,得滤液800.18g,干燥后得2g滤渣,则原混合物中氢氧化钙的质量是
| A.0.56g | B.1.12g | C.0.74g | D.1.48g |
(13分)在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想及做法:
(1)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。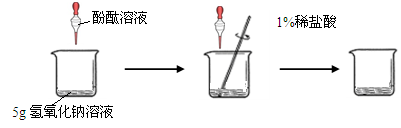
请回答:
①酚酞溶液的作用是 ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 。
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母)。
| A.将pH试纸剪成几段节约使用 |
| B.将pH试纸直接插入待测液中 |
| C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上 |
| D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上 |
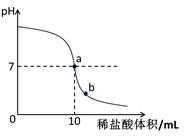
请回答:图中a点表示的含义是 ;b点溶液中含有的阳离子有 (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
请用化学方程式表示其变质的原因 ;若要除去溶液中变质生成的杂质,请简要写出你的实验方案: 。