题目内容
【题目】纯碱(Na2CO3)是一种重要的有机化工原料。侯氏制碱法制出的纯碱常含少量NaCl杂质,化学兴趣小组对工业纯碱样品进行实验探究。
Ⅰ研究Na2CO3的性质
(1)Na2CO3溶液显____(填“酸性”、“中性”或“碱性”)。
(2)检验样品中碳酸根的方法是____。
Ⅱ设计以下实验方案,测定样品中Na2CO3的质量分数。
[方案一]取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为____。
(4)实验中判断沉淀是否完全的方法是____。
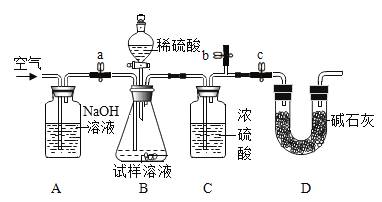
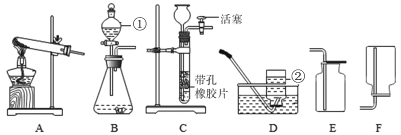
[方案二]采用如图装置,检查装置气密性;称取样品m1g于锥形瓶中,称装置D质量为m2 g;关闭止水夹c,打开止水夹a、b,缓慢鼓入空气数分钟,关闭止水夹a、b,打开止水夹c,缓慢加入稀硫酸至不再产生气体为止;打开止水夹a,缓慢鼓入空气数分钟,再称量装置D质量为m3g。
(查阅资料)浓硫酸具有吸水性,碱石灰的成分为CaO和NaOH固体
(5)装置B中发生的化学方程式为______。
(6)样品中Na2CO3的质量分数的计算式是______。
(7)反应后鼓入空气的目的是______。
(8)该测定结果比实际值偏高,从装置上分析其原因可能是______;改进措施为______。
【答案】碱性 取少量溶液于试管中,加入适量稀盐酸,产生气泡,把气体通入澄清石灰水中,澄清石灰水变浑浊,说明溶液中含有碳酸根 玻璃棒 继续滴加氢氧化钡溶液,不产生白色沉淀,说明沉淀完全 Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ ![]() 使反应生成的二氧化碳全部被碱石灰吸收 空气中的水蒸气和二氧化碳能被D装置吸收 在装置D后面再连接一个D装置
使反应生成的二氧化碳全部被碱石灰吸收 空气中的水蒸气和二氧化碳能被D装置吸收 在装置D后面再连接一个D装置
【解析】
(1)Na2CO3溶液显碱性。
(2)检验样品中碳酸根的方法是:取少量溶液于试管中,加入适量稀盐酸,产生气泡,把气体通入澄清石灰水中,澄清石灰水变浑浊,说明溶液中含有碳酸根。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为玻璃棒。
(4)实验中判断沉淀是否完全的方法是:继续滴加氢氧化钡溶液,不产生白色沉淀,说明沉淀完全。
(5)装置B中碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,发生的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑。
(6)设碳酸钠质量为x,

![]()
x=106/44(m3g-m2g),
样品中Na2CO3的质量分数的计算式是:![]()
(7)反应后鼓入空气的目的是使反应生成的二氧化碳全部被碱石灰吸收。
(8)该测定结果比实际值偏高,从装置上分析其原因可能是空气中的水蒸气和二氧化碳能被D装置吸收;改进措施:在装置D后面再连接一个D装置。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案