��Ŀ����
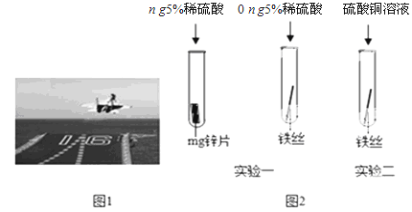
����Ŀ����8�֣����������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ��������������
��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ��� ��
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е� ��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
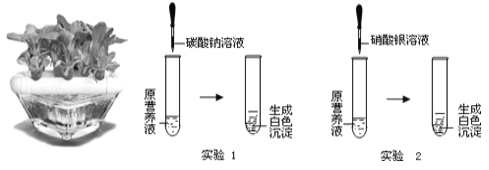
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ���������������� ��
��ʵ����У������� ����֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡���1�������ᣬǿ�ȴ�
��2��H2O��O2 Fe2O3 + 6HCl==FeCl3 + 3H2O
��3��������Ӵ��������ͬ ����˿�����к�ɫ�����۳� Fe + CuSO4==Cu + FeSO4
��������
�����������1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ����������ᣬǿ�ȴ�ʴ��ǿ
��2����������ʴ��Ҫ����������е�H2O��O2��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ�������������Ҫ�ɷ��������������÷�Ӧ�Ļ�ѧ����ʽΪ��Fe2O3 + 6HCl==FeCl3 + 3H2O
��3�������Ա������ʵ�飬һ��Ҫע����Ʊ�����ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ������������������һ���õ���пƬ��һ���õ�����˿��������Ӵ��������ͬ
�����Ļ��ǿ��ͭ���������û���ͭ����ʵ����г���������ʱ����˿�����к�ɫ�����۳�����Ӧ�Ļ�ѧ����ʽΪ��Fe + CuSO4==Cu + FeSO4

����Ŀ����7��+4�֣��ڹŴ������dz��ñ���(��Ҫ�ɷ���̼��ƣ����ʲ��μӷ�Ӧ�Ҳ�����ˮ)�ʹ���Ϊԭ����ȡ�ռijС��ͬѧ������ͼ��ʾ���̽���ʵ�飬�������̽�����ش�������⡣
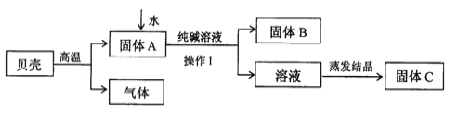
��1�����Ǹ��¶���ʱ��������Ӧ�Ļ�ѧ����ʽ�� ��
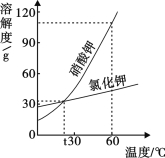
��2������I���õ��IJ����������ձ��� ����������
��3����Һ�����ᾧ�õ�����C�Ĺ����У����ò��������裬��Ŀ���� ��
�������뷢�֡���С��ͬѧ���ù���Cһ���Ǵ�����NaOH��?
[���������]���ݷ�Ӧԭ�����ס��ҡ�����λͬѧ������²��룺
�ף�������NaOH
�ң�NaOH��Na2CO3�Ļ����
����NaOH�� �Ļ����
��̽������֤���ס��ҡ�����λͬѧ�ֱ�������з��������Լ��IJ��������֤��ʵ�����������ͽ������±�����������ǵ�̽���������ȱ���ݡ�
ʵ����� | ���� | ���� | |
�� | ȡ��������C����������ˮ�γ���Һ�μӼ��η�̪��Һ | ��Һ��� | ������� |
�� | ȡ��������C����������ˮ�γ���Һ�μ������� | �����ݲ��� | ���벻���� |
�� | ȡ��������C����������ˮ�γ���Һ�μӼ��α���Na2CO3��Һ | ������� |
(ע�⣺������������⽱��4�֣���ѧ�Ծ��ֲܷ�����60�֡�)
����˼�����ۡ� ͬѧ�������о�ʵ�����̣����ۺ�һ����Ϊ ͬѧ��ʵ�鷽������ȷ�������� ��
����չ�������ʵ�鷽����֤ʵ���Ҿ��õ�����������Һ�Ѿ����ֱ��ʣ� ��