题目内容
为了测定某纯碱样品中碳酸钠的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数据如表.
请计算:
(1)该反应生成二氧化碳的质量为 g.
(2)该纯碱样品中碳酸钠的质量分数为多少.(请写出计算过程)
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 纯碱样品的质量/g | 烧杯和其中混合物的质量/g |
| 120 | 12 | 127.6 | |
(1)该反应生成二氧化碳的质量为
(2)该纯碱样品中碳酸钠的质量分数为多少.(请写出计算过程)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:反应前后的质量差即为生成二氧化碳的质量;
根据二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算该纯碱样品中碳酸钠的质量分数.
根据二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算该纯碱样品中碳酸钠的质量分数.
解答:解:(1)该反应生成二氧化碳的质量为:120g+12g-127.6g=4.4g,
故填:4.4.
(2)设样品中碳酸钠的质量为x,
2HCl+Na2CO3═2NaCl+H2O+CO2↑,
106 44
x 4.4g
=
,
X=10.6g,
样品中碳酸钠的质量分数为:
×100%=88.3%,
答:样品中碳酸钠的质量分数为88.3%.
故填:4.4.
(2)设样品中碳酸钠的质量为x,
2HCl+Na2CO3═2NaCl+H2O+CO2↑,
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
X=10.6g,
样品中碳酸钠的质量分数为:
| 10.6g |
| 12g |
答:样品中碳酸钠的质量分数为88.3%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
下列粒子结构示意图中,表示阴离子的是 ( )
A、 |
B、 |
C、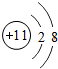 |
D、 |
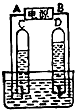 阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:?
阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:?