题目内容
【题目】纯净物A可用作燃料。在一定条件下,将一定质量的A与80g B按图所示充分反应,当B反应完全时,生成66g C和36g D
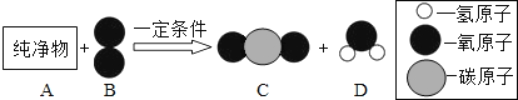
(1)一个D分子中共含有_____个原子。
(2)B、C、D三种物质中,属于氧化物的是_____。
(3)参加反应的A物质的质量是_____g,已知A的相对分子质量为44,则图示反应的化学方程式为_____。
【答案】3 CD 22 C3H8+5O2![]() 3CO2+4H2O
3CO2+4H2O
【解析】
根据反应的微观模拟示意图确定反应物A以及反应的化学方程式,在微观结构示意图中,由不同种原子构成的纯净物属于化合物,根据化学式的意义解答即可。
(1)由微粒的构成可知,一个D分子中共含有3个原子;
(2)由微粒的构成可知,B、C、D三种物质分别是氧气、二氧化碳和水,其中二氧化碳和水属于氧化物;
(3)在化学反应前后,反应前各物质的质量总和等于反应后生成的各物质的质量总和,故A的质量为:66g+36g﹣80g=22g,根据图示可以看出,反应的物质是A、氧气,生成的物质是二氧化碳和水,二氧化碳中碳元素的质量:66g×![]() ×100%=18g,水中氢元素的质量=36g×
×100%=18g,水中氢元素的质量=36g× ![]() ×100%=4g,18g+4g=22g,故A中只含有碳元素和氢元素,碳原子和氢原子的个数比为:
×100%=4g,18g+4g=22g,故A中只含有碳元素和氢元素,碳原子和氢原子的个数比为:![]() :
:![]() =3:8,A的相对分子质量为44,12×3+1×8=44,故A的化学式为:C3H8,故该反应的化学方程式为:C3H8+5O2
=3:8,A的相对分子质量为44,12×3+1×8=44,故A的化学式为:C3H8,故该反应的化学方程式为:C3H8+5O2![]() 3CO2+4H2O。
3CO2+4H2O。

练习册系列答案
相关题目