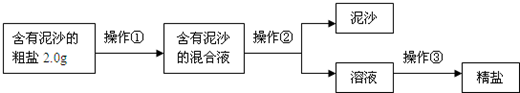
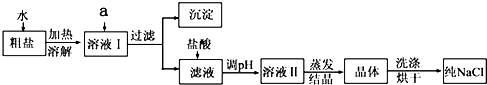
题目内容
将含有K2CO3和CaCl2两种固体的混合物,用足量的水溶解后得到白色沉淀,过滤,向滤液中滴加AgNO3溶液产生白色沉淀,再加稀HNO3,白色沉淀完全不溶解.下列判断不正确的是( )
| A.混合物溶于水,过滤后滤液中肯定不含CaCl2 |
| B.混合物溶于水,过滤后滤液中可能含K2CO3 |
| C.混合物溶于水,得到的白色沉淀是CaCO3 |
| D.滤液中滴加AgNO3溶液,产生的白色沉淀是AgCl |
A、根据滤液与AgNO3溶液反应生成的沉淀,滤液可能为KCl、CaCl2的混合溶液,则A说法不正确;
B、因最后滤液与AgNO3溶液反应生成的沉淀完全溶于酸中,则不会有碳酸银,即滤液中不会有K2CO3,则B说法不正确;
C、根据物质的组成和复分解反应的发生可推出混合物溶于水生成的沉淀为CaCO3,则C说法正确;
D、因滤液与AgNO3溶液反应生成的沉淀不溶于酸,则白色沉淀为AgCl,则D说法正确.
故选AB.
B、因最后滤液与AgNO3溶液反应生成的沉淀完全溶于酸中,则不会有碳酸银,即滤液中不会有K2CO3,则B说法不正确;
C、根据物质的组成和复分解反应的发生可推出混合物溶于水生成的沉淀为CaCO3,则C说法正确;
D、因滤液与AgNO3溶液反应生成的沉淀不溶于酸,则白色沉淀为AgCl,则D说法正确.
故选AB.

练习册系列答案
相关题目
 基本反应类型中的
基本反应类型中的