题目内容
向稀硫酸溶液中慢慢滴加氢氧化钡溶液直至过量,下列图象中能正确表示其变化的是( )

A. ①③ B. ②③ C. ①④ D. ②④
今年扬州迎来高铁交通发展的高潮。高铁给我们带来的不仅是交通方便,出行快捷,甚至是带来旅游业的繁荣。制造铁轨需要大量的合金钢,梅岭中学化学兴趣小组为此展开探究:
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
(1)炼铁的固体原料中加入焦炭的作用是______________、___________(用方程式表示);
(2)炼铁的固体原料需经过粉碎,其目的是____________________ 。
(3)热空气和高炉气体的主要成分有一种相同,这种气体是________(填化学式);
(4)炼钢炉中,通入纯氧而不用空气的目的是____________________。将钢锭轧成钢板,体现了金属的________性。
(二)该兴趣小组发现未经处理的钢铁容易生锈。同学们接着探究了铁生锈的相关问题。
(知识回顾)铁生锈的条件为铁与_______、_______同时接触,为了防止铁制品生锈,应采取的措施是__________(写出一种)。
(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3•xH2O,在加热时会分步反应, 首先失去结晶水,其反应可表示为Fe2O3•nH2O=Fe2O3+nH2O浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3•nH2O)中n的值等于多少呢?
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。
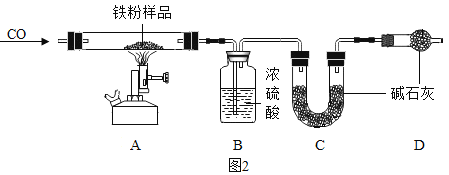
(1)实验前应先_______________;
(2)为了保证实验安全,实验开始时应先__________,目的是_______________;
(3)A中的现象是 ________________;
(4)请指出该装置中有一处明显不足 _____________;
(数据处理)如图是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |

(5)铁锈(Fe2O3•nH2O)中n的值是_____;
(6)写出T3-T4时间段发生反应的化学方程式 _______________________;
(7)计算原样品中单质铁的质量分数是________。(计算结果保留到0.1%)
一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 50 | 0.5 | 0 | 0 |
反应后的质量/g | 23 | X | 24 | 3 |
A. x的值等于0.5 B. 甲一定是化合物
C. 丙和丁的质量变化比为8:1 D. 该反应是化合反应


 溶液中,铁丝表面覆盖了红色物质,一会儿又有气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是
溶液中,铁丝表面覆盖了红色物质,一会儿又有气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是 并检验
并检验


