题目内容
某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验;取11.0g纯碱样品放入烧杯中,再把100g稀盐酸平均分成四份依次加入样品中,充分反应后,实验数据记录如下:| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 所加盐酸的质量/g | 25 | 25 | 25 | 25 |
| 烧杯中所盛物质的总质量/g | 34.2 | 57.4 | 81.6 | 106.6 |
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
分析:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,故生成二氧化碳的质量=反应所盛物质的质量总和-反应后所盛物质的质量总和,分析表格中所给的实验数据,可知在反应过程中,烧杯内的物质的总质量不断减少,所减少的质量即为二氧化碳的质量.由二氧化碳的质量可以求出碳酸钠的质量分数.
解答:解:(1)由表格数据可知,第一次生成二氧化碳的质量为:11.0g+25g-34.2g=1.8g;
(2)分析可知,第二次生成二氧化碳的质量是3.6g,第三次生成二氧化碳的质量是4.4g,第四次仍然是4.4g,说明产品中碳酸钠在第三次就已经完全反应且恰好完全反应,最多生成二氧化碳的质量为:25g×3+11.0g-81.6g=4.4g.
设样品中含有的碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 4.4g
=
产品中碳酸钠的质量分数为:
×100%≈96.4%≥96%;
故该产品中碳酸钠的质量分数合格.
故答案为:
(1)1.8
(2)设样品中含有的碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 4.4g
=
产品中碳酸钠的质量分数为:
×100%≈96.4%≥96%;
故该产品中碳酸钠的质量分数合格.
(2)分析可知,第二次生成二氧化碳的质量是3.6g,第三次生成二氧化碳的质量是4.4g,第四次仍然是4.4g,说明产品中碳酸钠在第三次就已经完全反应且恰好完全反应,最多生成二氧化碳的质量为:25g×3+11.0g-81.6g=4.4g.
设样品中含有的碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 4.4g
| 106 |
| X |
| 44 |
| 4.4g |
产品中碳酸钠的质量分数为:
| 10.6g |
| 11g |
故该产品中碳酸钠的质量分数合格.
故答案为:
(1)1.8
(2)设样品中含有的碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 4.4g
| 106 |
| X |
| 44 |
| 4.4g |
产品中碳酸钠的质量分数为:
| 10.6g |
| 11g |
故该产品中碳酸钠的质量分数合格.
点评:本题主要考查学生运用化学方程式计算和分析表格数据解决问题的能力,在有表格的计算中,我们通常要用到质量守恒定律分析表格中所给的数据,得出我们所需要的物质的质量,然后再利用化学方程式进行计算.

练习册系列答案
相关题目
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是 .
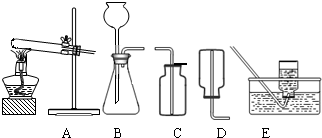
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为 ,制取和收集氨气可用下图中的 和 装置.
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是 g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
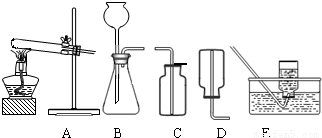
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
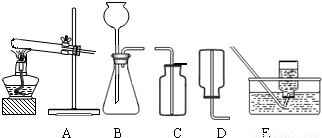
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
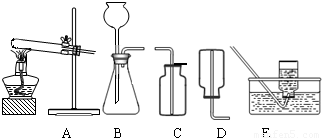
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)