题目内容
在学习完“金属和金属材料”后,小聪同学对所学过的与金属有关的知识进行了归纳整理,他发现:常见的金属一般具有如下性质:①与氧气反应;②与某些酸反应;③与某些金属化合物的溶液反应(如硫酸铜溶液).经分析、比较,他又发现金属的这些性质与金属的活动性间似乎存在一定的联系.如只有活动性强的金属(锌、铁等)才能将活动性弱的金属(如铜)从它的化合物溶液中置换出来,这是金属具有性质③的原因.
请你和小聪一起来分析、思考,举例说明金属的活动性在金属的下列性质中是如何得以体现的:
(1)性质①:
(2)性质②:
同学们从小聪的发现中得到鼓舞,决定探究金属活动性与金属元素的原子结构间的关系,他们列举了如图所示的金属的原子结构示意图:
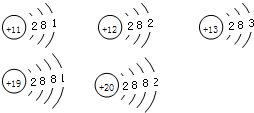
(3)通过对上图进行分析,他们发现金属的活动性与该金属的原子结构有着密切的关系.相信你也有所发现!请将你的结论写下来:
①
② .
请你和小聪一起来分析、思考,举例说明金属的活动性在金属的下列性质中是如何得以体现的:
(1)性质①:
(2)性质②:
同学们从小聪的发现中得到鼓舞,决定探究金属活动性与金属元素的原子结构间的关系,他们列举了如图所示的金属的原子结构示意图:

(3)通过对上图进行分析,他们发现金属的活动性与该金属的原子结构有着密切的关系.相信你也有所发现!请将你的结论写下来:
①
②
考点:金属的化学性质,原子结构示意图与离子结构示意图
专题:金属与金属材料
分析:(1)根据金属与氧气,与酸反应的规律举例说明;
(2)根据元素的原子结构图中最外层电子数,判断元素在化学反应中表现出的性质;根据原子的核外电子排布与元素的化学性质的有密切关系,由金属活动性与金属的原子结构,判断金属活动性与原子结构的关系.
(2)根据元素的原子结构图中最外层电子数,判断元素在化学反应中表现出的性质;根据原子的核外电子排布与元素的化学性质的有密切关系,由金属活动性与金属的原子结构,判断金属活动性与原子结构的关系.
解答:解:(1)在常温下,镁比铁更容易与氧气发生化学反应;
故答案为:活动性越强的金属越容易与氧气反应,如镁比铁易与氧气反应;(合理即可)
(2)金属活动性越强,则金属与酸反应速率越快;
故答案为:活动性越强的金属与酸反应的速率越快,如镁比铁与酸反应的速率快(合理即可);
(3)根据元素的原子结构图,最外层电子数小于4时,易失电子;
钠、铝、镁三种原子的电子层数相同,最外层电子数依次变大,而三种金属的活动性Na>Mg>Al;钾、钙两原子的电子层数相同,最外层电子数也依次变大,而二种金属的活动性为为K>Ca;可判断当电子层数相同时,最外层电子数越小,其活动性相对较强;
钾、钠两原子的最外层电子数相同,核外电子层数增加,且两金属的活动性K>Na;钙、镁两原子的最外层电子数相同,核外电子层数增加,且两金属的活动性Ca>Mg;可判断当最外层电子数相同时,电子层数越少,其活动性相对较弱;
故答案为:五种金属的原子最外层电子数都小于4,在化学反应中都易失去电子;当五种金属的原子的电子层数相同时,最外层电子数越小,越容易失去电子,其活动性相对较强(或当最外层电子数相同时,电子层数越少,其活动性相对较弱).
故答案为:活动性越强的金属越容易与氧气反应,如镁比铁易与氧气反应;(合理即可)
(2)金属活动性越强,则金属与酸反应速率越快;
故答案为:活动性越强的金属与酸反应的速率越快,如镁比铁与酸反应的速率快(合理即可);
(3)根据元素的原子结构图,最外层电子数小于4时,易失电子;
钠、铝、镁三种原子的电子层数相同,最外层电子数依次变大,而三种金属的活动性Na>Mg>Al;钾、钙两原子的电子层数相同,最外层电子数也依次变大,而二种金属的活动性为为K>Ca;可判断当电子层数相同时,最外层电子数越小,其活动性相对较强;
钾、钠两原子的最外层电子数相同,核外电子层数增加,且两金属的活动性K>Na;钙、镁两原子的最外层电子数相同,核外电子层数增加,且两金属的活动性Ca>Mg;可判断当最外层电子数相同时,电子层数越少,其活动性相对较弱;
故答案为:五种金属的原子最外层电子数都小于4,在化学反应中都易失去电子;当五种金属的原子的电子层数相同时,最外层电子数越小,越容易失去电子,其活动性相对较强(或当最外层电子数相同时,电子层数越少,其活动性相对较弱).
点评:本题考查了金属活动性顺序的意义及运用以及根据金属活动性顺序强弱关系,对比金属元素的原子的核外电子排布,归纳金属活动性与原子的核外电子排布的规律,体现了结构体现了性质.

练习册系列答案
相关题目
当危险发生时,以下应急措施正确的是( )
| A、室内发生火灾时,打开所有门窗通风 |
| B、煤气泄漏时,打开电灯检查漏气管道 |
| C、地震发生时,底楼的同学快速跑到空旷的地方 |
| D、有人触电时立即用手把触电者拉开 |
下列实验现象描述正确的是( )
| A、木炭在氧气中燃烧,发出白光,生成黑色固体 |
| B、铁丝在氧气中燃烧,火星四射,生成黑色固体 |
| C、红磷在氧气中燃烧,产生大量的白雾 |
| D、硫在氧气中燃烧,产生淡蓝色火焰 |