题目内容
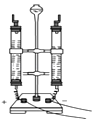
【题目】化学是一门以实验为基础的学科,根据如图,回答问题.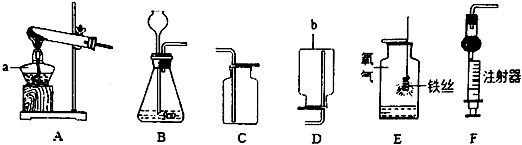
(1)仪器a的名称是 , 仪器b的名称是;
(2)实验室用过氧化氢和二氧化锰制取氧气,选用的发生装置是(填字母序号),二氧化锰起作用;
(3)实验室制取二氧化碳选用的收集装置是(填字母序号),制取二氧化碳时,用装置F替代装置B的优点是 .
【答案】
(1)酒精灯,集气瓶
(2)B,催化
(3)C,可以控制液体的滴加速率;(或可以控制反应的发生和停止;或可以节约药品)
【解析】(1)酒精灯是常用的加热仪器,集气瓶是常用的收集气体的仪器;
(2)如果用双氧水和二氧化锰制氧气就要用装置A,其中二氧化锰起催化作用;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;制取二氧化碳时,用装置F替代装置B的优点是:可以控制液体的滴加速率;或可以控制反应的发生和停止;或可以节约药品;故答案为:C;可以控制液体的滴加速率;(或可以控制反应的发生和停止;或可以节约药品).
故答案为:(1)酒精灯;集气瓶;(2)B;催化;(3)C;可以控制液体的滴加速率;(或可以控制反应的发生和停止;或可以节约药品).
(1)根据常用仪器的名称解答即可;
(2)根据过氧化氢和二氧化锰的状态和反应条件可选择发生装置,二氧化锰在此反应中做催化剂;
(3)根据二氧化碳的密度以及溶于水的程度可以选择收集装置;装置F的注射器中有刻度,可以控制反应的用量,而且可以随时控制反应的发生或者停止.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国是一个钢铁大国,钢铁产量为世界第一。某化学实验小组的同学用下面的装置在实验室中模拟炼铁。请你和他们一起完成相关探究。
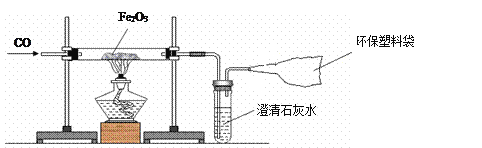
(1)操作顺序是实验成败的关键,对于该实验,应______________________(填“先通入一氧化碳”或“先点燃酒精灯”)。
(2)反应中可观察到粗玻璃管内的实验现象为__________________,写出该反应的化学方程式__________________________________________________。
(3)产物的检验:
①初步检验:甲同学想对反应后的产物进行初步检验,请你帮他想出一个物理方法:______。
②进一步验证:乙同学想用化学方法对产物进一步验证,他将反应后的黑色粉末加入足量的硫酸铜溶液中,发现只有部分变成红色。请写出生成红色物质的化学方程式:____________。
(4)质疑与探究:
①乙同学对产物的成分产生了质疑,查阅相关资料之后得知,一氧化碳还原氧化铁是一个逐渐的过程。
首先是Fe2O3被还原为Fe3O4:3Fe2O3 + CO![]() 2Fe3O4 + CO2。
2Fe3O4 + CO2。
然后是Fe3O4被还原为FeO:CO + Fe3O4![]() ______ + CO2。
______ + CO2。
最后是FeO被还原为Fe:FeO + CO ![]() Fe + CO2
Fe + CO2
②通过以上分析,甲乙两位同学对反应后黑色固体的成分进行了猜想:
已知:FeO、Fe3O4均为黑色,且Fe3O4有磁性。FeO、Fe3O4都不与硫酸铜溶液反应。
猜想一:Fe与Fe3O4; 猜想二:Fe与FeO; 猜想三:Fe与Fe3O4和FeO。
③为了对产物固体的成分进行更客观的分析,甲乙同学将所做实验整理如下:
实验内容 | 实验现象 | 实验结论 |
将反应后得到的黑色粉末 用磁铁吸引 | _____________ | 猜想一成立 |
将反应后得到的黑色粉末 加入足量的硫酸铜溶液中 | _____________ |
④实验反思:为了提高铁的产率,应适当_______(填“降低”或“提高”)反应温度。
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.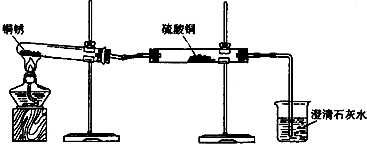
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3 . ②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
(1)【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有; |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
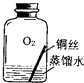
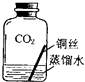
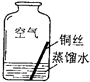
(2)【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | ①实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是 |