题目内容
将220克过氧化氢溶液加入到盛有6克二氧化锰的锥形瓶中,反应完全后称得物质的总质量为222.8克,求:
(1)反应中消耗过氧化氢多少克?
(2)反应后的物质中含有二氧化锰多少克?
解:(1)根据质量守恒定律,氧气的质量=220g+6g-222.8g=3.2g,设反应中消耗过氧化氢的质量为x
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
x 3.2g

x=6.8g
答:反应中消耗过氧化氢的质量为6.8g.
故答案为:6.8g
(2)催化剂二氧化锰的质量和化学性质在反应的前后没有变化,故答案为:6g
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,根据质量守恒定律求氧气的质量,再根据氧气的质量求消耗过氧化氢的质量;催化剂二氧化锰的质量和化学性质在反应的前后没有变化.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在计算题中.
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
x 3.2g

x=6.8g
答:反应中消耗过氧化氢的质量为6.8g.
故答案为:6.8g
(2)催化剂二氧化锰的质量和化学性质在反应的前后没有变化,故答案为:6g
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,根据质量守恒定律求氧气的质量,再根据氧气的质量求消耗过氧化氢的质量;催化剂二氧化锰的质量和化学性质在反应的前后没有变化.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在计算题中.

练习册系列答案
相关题目
 小明用如图所示装置进行“微粒是不断运动”的探究.一段时间后,可观察到紫色石蕊溶液变红,则物质A是
小明用如图所示装置进行“微粒是不断运动”的探究.一段时间后,可观察到紫色石蕊溶液变红,则物质A是 .当a=________时该粒子是原子、当a=8时,该粒子符号为________;
.当a=________时该粒子是原子、当a=8时,该粒子符号为________;  其中“
其中“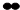 ”、“
”、“ ”、“
”、“ ”、“
”、“ ”分别表示不同的分子或原子,则反应所属的基本反应类型为
”分别表示不同的分子或原子,则反应所属的基本反应类型为