题目内容
某硫酸厂废水中含有少量硫酸,为达标排放,需对废水中硫酸的含量进行检测.请计算:
(1)欲用10%的氢氧化钠溶液配制溶质质量分数为4%的NaOH溶液100g,需要加水 g.
(2)取废水样品100g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH溶液20g,(假设废水中其它成分均不和NaOH反应).试计算废水中硫酸的质量分数.
(1)欲用10%的氢氧化钠溶液配制溶质质量分数为4%的NaOH溶液100g,需要加水
(2)取废水样品100g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH溶液20g,(假设废水中其它成分均不和NaOH反应).试计算废水中硫酸的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)利用溶质质量=溶液质量×溶质的质量分数,根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答;
(2)依据化学方程式的基本计算分析解答.
(2)依据化学方程式的基本计算分析解答.
解答:解:
(1)需要100g溶质质量分数为4%的氢氧化钠溶液,她若用10%的氢氧化钠溶液配制,设需要10%的氢氧化钠溶液的质量为x,溶液稀释前后,溶质的质量不变,则100g×4%=10%x,x=40g;需要蒸馏水的质量为100g-40g=60g.
(2)氢氧化钠的质量=20g×4%=0.8g
设硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98 80
x 0.8g
=
x=0.98g
废水中硫酸的质量分数=
×100%=0.98%
答案:
(1)60;
(2)废水中硫酸的质量分数0.98%
(1)需要100g溶质质量分数为4%的氢氧化钠溶液,她若用10%的氢氧化钠溶液配制,设需要10%的氢氧化钠溶液的质量为x,溶液稀释前后,溶质的质量不变,则100g×4%=10%x,x=40g;需要蒸馏水的质量为100g-40g=60g.
(2)氢氧化钠的质量=20g×4%=0.8g
设硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98 80
x 0.8g
| 98 |
| 80 |
| x |
| 0.8g |
x=0.98g
废水中硫酸的质量分数=
| 0.98g |
| 100g |
答案:
(1)60;
(2)废水中硫酸的质量分数0.98%
点评:本题难度不大,掌握溶液稀释前后溶质的质量不变、溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
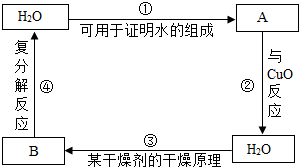 课外活动时,同学们玩起了在特定条件下,以水为主题的“化学反应接龙”(前一反应的一种生成物为下一反应的反应物)游戏,请按要求回答问题.
课外活动时,同学们玩起了在特定条件下,以水为主题的“化学反应接龙”(前一反应的一种生成物为下一反应的反应物)游戏,请按要求回答问题. 随着生活质量的提高,人们越来越关注自身的健康.
随着生活质量的提高,人们越来越关注自身的健康. 如图为A、B、C三种固体物质的溶解度曲线,据图回答:
如图为A、B、C三种固体物质的溶解度曲线,据图回答: