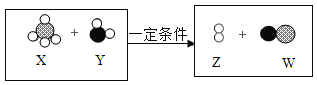
题目内容
【题目】根据下列要求回答问题.
(1)在干冰、铜、氯化钠三种物质中,由分子构成的物质是_____;
(2)在盛有少量稀盐酸的试管中加入足量碳酸钙,振荡。
①宏观现象:可观察到_____,固体逐渐减少并消失;
②符号表征:该反应的化学方程式为_____;该反应在实验室用于制取_____(填化学式);
③微观表征:加入碳酸钙前后溶液中主要离子种类及个数比变化示意图如图,由图判断,增加离子是_____,减少的离子是_____(填离子符号)。

【答案】干冰 产生气泡 2HCl+CaCO3=CaCl2+H2O+CO2![]() CO2 Ca2+ H+
CO2 Ca2+ H+
【解析】
(1)干冰是二氧化碳固体,是由二氧化碳分子构成,铜是由铜原子构成,氯化钠是由钠离子和氯离子构成,故填写:干冰;
(2)在盛有少量稀盐酸的试管中加入足量碳酸钙,观察到产生气泡,固体逐渐减少并消失,故填写:产生气泡;
盐酸与碳酸钙反应生成二氧化碳、水和氯化钙,故填写:2HCl+CaCO3=CaCl2+H2O+CO2![]() ;
;
该反应在实验室用于制取二氧化碳,故填写:CO2;
由图可知,反应前后增加的图形是,黑色圆圈,代表钙离子,减少的图形为小白圆圈,代表氢离子,故填写:Ca2+、H+。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某化学兴趣小组的同学需要制取一瓶氧气,请与他们一起进行实验之旅
(选择药品)小组同学查阅文献资料,获得了下列信息:过氧化氢、氯酸钾、高锰酸钾等在一定的条件下分解都可以产生氧气。其中过氧化氢溶液价格最低,常温时,在二氧化锰的催化作用下能够迅速分解放出氧气,该过程无副产物;氯酸钾固体价格较高,分解较困难,且常伴有副产物;高锰酸钾固体价格较高,加热即可快速分解。
(1)经讨论,过氧化氢、氯酸钾、高锰酸钾都能产生氧气,是因为______________ (填序号)
①三种方法所需仪器相同 ②反应都需要加热 ③都利用含氧元素化合物分解达到目的
(2)在选择制氧气的原料时,除了要含有所需的元素外,往往还需要考虑_______________等因素(填一条即可)
(明确原理)经过比较,同学们选择过氧化氢作为实验室制取氧气的原料,所发生化学反应的符号表达式为____________。
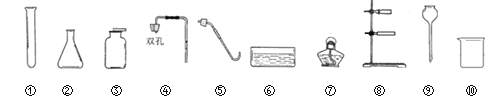
(选择装置)根据下列实验装置图,请回答问题。
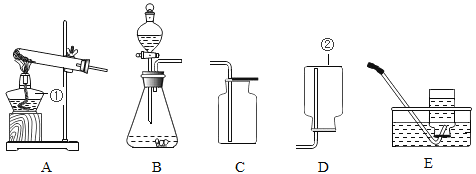
(1)写出上图中标有序号的仪器名称:①_____;②_____。
(2)实验室制取气体时,组装好仪器后,应先___,再添加药品。
(3)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是____(选填装置序号)。
(4)利用排空气发收集气体时导管口要接近集气瓶底部,其目的是_________。
(5)因为氧气不易溶于水,所以可以利用装置______(选填装置序号)收集。
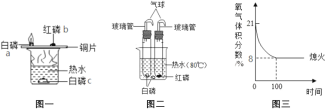
(实验方法)“化学反应条件的控制是实验的灵魂”。化学兴小组的同学在老师指导下,进行了“影响过氧化氢溶液分解因素”的探究实验。下表是该小组探究影响过氧化氢分解速率的因素的相关实验数据。请你分析回答:
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 17 |
② | 15 | 1 | 20 | 0.1 | 4 | 67 |
③ | 30 | 5 | 35 | 2 | 49 | |
④ | 30 | 5 | 55 | 2 | 11 |
(1)通过实验①和②对比可知,化学反应速率与____________有关;
(2)从实验______和______对比可知,化学反应速率与温度的关系是:__________。