题目内容
【题目】工业制氧气主要有下列步骤。
![]()
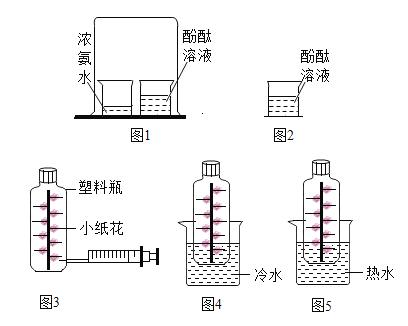
(1)从步骤②可以看出氮气的沸点比氧气的沸点_______(填“高”或“低”)。
(2)工业制氧气属于_________变化。
(3)储存在蓝色钢瓶里的“工业液氧”是_______(填“混合物”或“纯净物”)
(4)用_______可以区分空气、“工业液氧”和二氧化碳。
【答案】低 物理 混合物 燃着的木条
【解析】
(1)从步骤②可知,氮气先从液态空中分离出去,可以得出氮气的沸点比氧气的沸点低;故填:低;
(2)工业制氧气是根据空气中各组成沸点的不同加以分离的方法,没有新物质生成,属于物理变化;故填:物理;
(3)贮存在蓝色钢瓶里的“工业液氧”是混合物;故填:混合物;
(4)用燃着的木条可以区分空气、“工业液氧”和二氧化碳,燃烧更旺的是工业液氧,无明显变化的是空气,熄灭的是二氧化碳;故填:燃着的木条。

【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
【题目】二氧化碳是自然界中一种重要的资源。
一、二氧化碳的用途
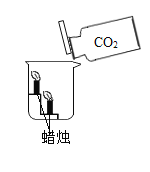
(1)下图实验,观察到的现象是________,说明二氧化碳可用于________。
(2)自然界中,二氧化碳可通过________作用,产生氧气。
(3)将二氧化碳加压、降温制成固态二氧化碳,俗称______,可用于人工降雨、舞台云雾等。
二、二氧化碳的制取
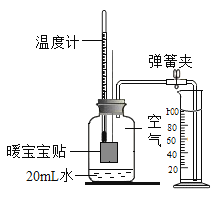
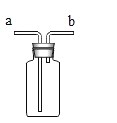
(1)实验室可用下图装置A制CO2,a中加入的物质是_____。反应的符号表达式是______。
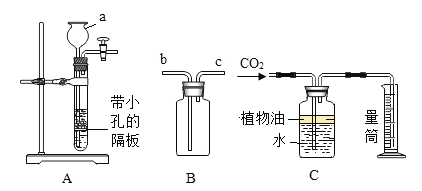
(2)装置B和C均可以收集CO2,若用B收集则气体应从_____端(选填“b”或“c”)通入。若用C装置收集,植物油的作用是_____。
三、二氧化碳的测定
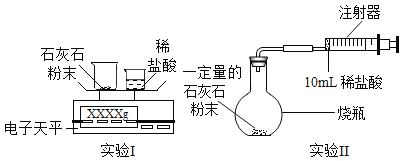
测定石灰石(主要成分为碳酸钙,其他物质不与酸反应)与稀盐酸(实验中酸均足量)反应生成CO2的质量和体积,并处理数据。
(实验设计)通过下列两个实验分别测定CO2的质量和体积,并处理数据。
(分析与思考)
(1)实验1时,将小烧杯中稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中碳酸钙完全反应的操作及实验现象是:最后一次加入稀盐酸,________。
(2)实验2时,先连接装置,再_______(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。
(记录与处理)
(1)实验1中电子天平的精确度较高,已知:反应前的总质量(m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)),要计算生成CO2的质量,至少还需要的数据是_______。(填字母)
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
(2)实验2的实验记录如下(表中数据在相同温度、相同压强条件下测定)
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
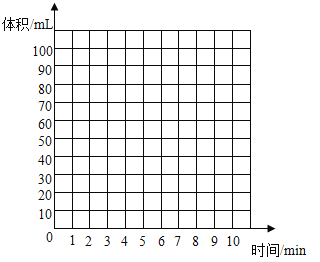
①综合分析,最终生成CO2的体积是________ml。
②在坐标图中用曲线绘制出0-10min生成CO2体积随时间变化的曲线._______
(反思与评价)请你综合各方面原因分析
(1)实验1操作简单,便于读数,但最终CO2质量的测量值比理论值偏大,可能的原因是_____。
(2)实验Ⅱ的优点是_______。