题目内容
有一包白色固体,可能含有碳酸钠、硫酸铜、氯化钙、硫酸钠、氯化钠等物质中的一种或几种,现取部分该固体溶于水,可得到澄清的无色溶液,向其中滴入氯化钡溶液,产生白色沉淀,再加入足量的稀硝酸,沉淀部分消失.请回答:
(1)该固体中一定含有________,一定不含有________,可能含有________.
(2)写出其中两个反应的化学方程式.
(3)请你设计一个实验,证明白色固体中可能含有的物质是否存在.________.
解:因该固体溶于水,可得到澄清的无色溶液,我们可判断一定不含硫酸铜,因硫酸铜溶液为蓝色.
又因向其中滴入氯化钡溶液,产生白色沉淀,再加入足量的稀硝酸,沉淀部分消失.可得混合物中一定含有硫酸钠和碳酸钠,一定不含氯化钙.因氯化钙与碳酸钠不共存.没有确定有还是没有的是氯化钠.
在碳酸钠和硫酸钠的混合物中确定是否含有氯化钠,需要将碳酸钠和硫酸钠对氯化钠的干扰去除,所以需要沉淀掉碳酸根离子和硫酸根离子,所以固体溶于水后后加入氢氧化钡(或者硝酸钡)溶液至过量,过滤后将滤液中加入稀硝酸后滴加硝酸银,如果生成沉淀,则证明有氯化钠,反之则无.(检验氯离子
故答案为:
(1)碳酸钠、硫酸钠;硫酸铜、氯化钙;氯化钠.
(2)BaCl2+Na2CO3=BaCO3↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
(3)在碳酸钠和硫酸钠的混合物中确定是否含有氯化钠,需要将碳酸钠和硫酸钠对氯化钠的干扰去除,所以需要沉淀掉碳酸根离子和硫酸根离子,所以需要固体溶于水后加入氢氧化钡(或者硝酸钡)溶液至过量,过滤后将滤液中加入稀硝酸后滴加硝酸银,如果生成沉淀,则证明有氯化钠,反之则无.
分析:在确定混合物中的组成成分时,首先根据在水溶液中的颜色来判断一定有哪种物质,一定没有哪种物质,没有确定的是可能存在的.
点评:氯化钙能与硫酸钠和碳酸钠反应,都能得到沉淀,但所得的沉淀中碳酸钡能溶于酸,而硫酸钡不能溶于酸.所以我们可以确定在混合物中同时有硫酸钠和碳酸钠.
又因向其中滴入氯化钡溶液,产生白色沉淀,再加入足量的稀硝酸,沉淀部分消失.可得混合物中一定含有硫酸钠和碳酸钠,一定不含氯化钙.因氯化钙与碳酸钠不共存.没有确定有还是没有的是氯化钠.
在碳酸钠和硫酸钠的混合物中确定是否含有氯化钠,需要将碳酸钠和硫酸钠对氯化钠的干扰去除,所以需要沉淀掉碳酸根离子和硫酸根离子,所以固体溶于水后后加入氢氧化钡(或者硝酸钡)溶液至过量,过滤后将滤液中加入稀硝酸后滴加硝酸银,如果生成沉淀,则证明有氯化钠,反之则无.(检验氯离子
故答案为:
(1)碳酸钠、硫酸钠;硫酸铜、氯化钙;氯化钠.
(2)BaCl2+Na2CO3=BaCO3↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
(3)在碳酸钠和硫酸钠的混合物中确定是否含有氯化钠,需要将碳酸钠和硫酸钠对氯化钠的干扰去除,所以需要沉淀掉碳酸根离子和硫酸根离子,所以需要固体溶于水后加入氢氧化钡(或者硝酸钡)溶液至过量,过滤后将滤液中加入稀硝酸后滴加硝酸银,如果生成沉淀,则证明有氯化钠,反之则无.
分析:在确定混合物中的组成成分时,首先根据在水溶液中的颜色来判断一定有哪种物质,一定没有哪种物质,没有确定的是可能存在的.
点评:氯化钙能与硫酸钠和碳酸钠反应,都能得到沉淀,但所得的沉淀中碳酸钡能溶于酸,而硫酸钡不能溶于酸.所以我们可以确定在混合物中同时有硫酸钠和碳酸钠.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
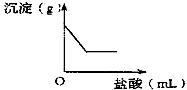 (2008?上海)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
(2008?上海)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )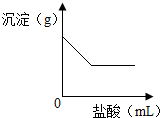 (2013?武清区一模)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
(2013?武清区一模)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )