题目内容
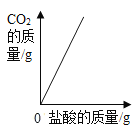
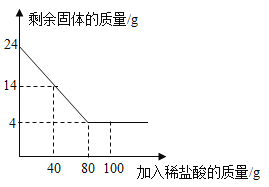
【题目】某化学兴趣小组为了测定当地的石灰石(主要成分是![]() )的质量分数,他们做了如下实验;取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
)的质量分数,他们做了如下实验;取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
(1)石灰石样品中![]() 的百分含量为_________。(保留两位小数)
的百分含量为_________。(保留两位小数)
(2)12克石灰石样品与盐酸充分反应后最多产生二氧化碳的质量为______克.
(3)求所用盐酸的溶质质量分数_______.(请根据化学方程式写出完整的计算步骤)
【答案】83.33% 4.4 18.25%(详见解析)
【解析】
(1)由图像可知最终反应后固体的固体为4g,该质量即是剩余的不反应的杂质的质量,所以石灰石中碳酸钙的质量是24g-4g=20g;石灰石样品中![]() 的百分含量=
的百分含量=![]() ;
;
(2)根据第(1)小题的分析可知,12克石灰石样品中含碳酸钙的质量为10g。
设:生成的二氧化碳的质量是x。
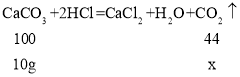
![]() x=4.4g;
x=4.4g;
(3)由图像可知,12克石灰石样品中碳酸钙与盐酸恰好反应时的用量是40g;
设:参加反应的盐酸中HCl的质量为y.
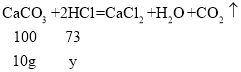
![]() y=7.3g;
y=7.3g;
所用盐酸的质量分数=![]() 。
。

练习册系列答案
相关题目
【题目】下列图像能正确反映对应变化关系的是 ( )
|
|
|
|
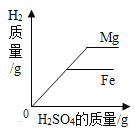
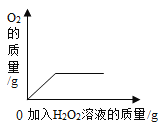
A. 一定质量的碳酸钙中不断加入盐酸 | B向等质量的镁、铁两种金属,分别放入同浓度的稀硫酸 | C.用酒精灯加热一定质量的高锰酸钾固体 | D.向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液 |
A. AB. BC. CD. D